Puntos a Evaluar
- Epidemiología y causas de la muerte fetal intrauterina
- Fisiopatología de la incompatibilidad de grupo y Rh
- Diagnóstico de incompatibilidad y anemia fetal
- Prevención de la isoinmunización por Rh
- Etiología y diagnóstico del hídrops fetal de causa inmune y no inmune
- Trombofilias?
- Nivel: ¿?
Muerte Fetal Intrauterina (MFIU)
En Chile, se define óbito fetal como la muerte del feto entre las 22 semanas de gestación o desde que éste pese 500gr, hasta el parto, incluyendo desde el 2005 a todos los fetos que nacen muertos (independiente del peso, EG y/o viabilidad extrauterina).
El diagnóstico se hace frente a la ausencia de LCF, asociado a otros indicadores ecográficos como postura fetal anormal, extensión de la columna vertebral, deformidad de la calota por sobreposicion de huesos, edema del cuero cabelludo (halo) y oligoamnios.
Epidemiología
Desde los 70, las muertes fetales han ido en descenso, sin embargo en la última década han vuelto aumentar (de 4,3/1000 en 2000 hasta 8,6 en 2010), supuestamente porque en 2005 se comenzaron a sumar los mortinatos.
De los 8,1/1000 de 2010, el 31% eran >32 semanas, que probablemente pudieron haber sobrevivido fuera del útero.
En países desarrollados, el 90% de las muertes ocurren en el ante parto y solo un 10% durante este, principalmente por asfixia perinatal.
Hoy en día se sabe que este es un evento recurrente, por lo que es fundamental encontrar la causa para prevenir la muerte del feto en embarazos a futuro.
Etiología
Las causas de MFIU se clasifican según su origen en
- Fetales (25%): principalmente hipoxia (la mitad de estas), malformaciones congénitas y las cromosomopatías.
- Placentarias (25 a 30%): son inversamente proporcionales a las desconocidas, en este grupo predomina la RCIU
- Maternas (10%): actualmente en aumento en nuestro país.
- No se logra determinar en un 15 a 40%.
Se debe enfatizar a los padres sobre la importancia de encontrar la causa, para lo cual se debe realizar:
- Estudio Clínico:
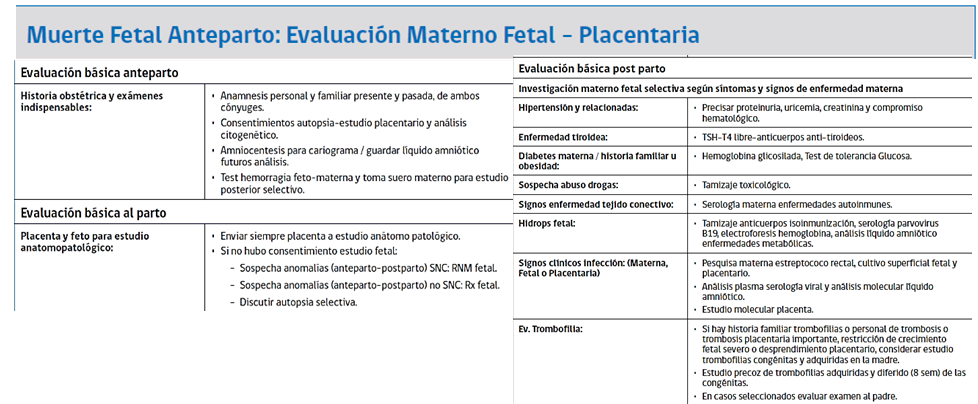
- Estudio Anatomopatológico: mediante autopsia fetal, estudio histopatológico y evaluación citogenética del líquido amniótico, con lo que se con lo que se consigue hallar la causa en un 70 a 75% de los casos. Sin embargo estos exámenes requieren del consentimiento informado por parte de los padres, el que muchas veces es difícil de conseguir, en este caso son de utilidad las imágenes: TAC o RNM de cuerpo total.
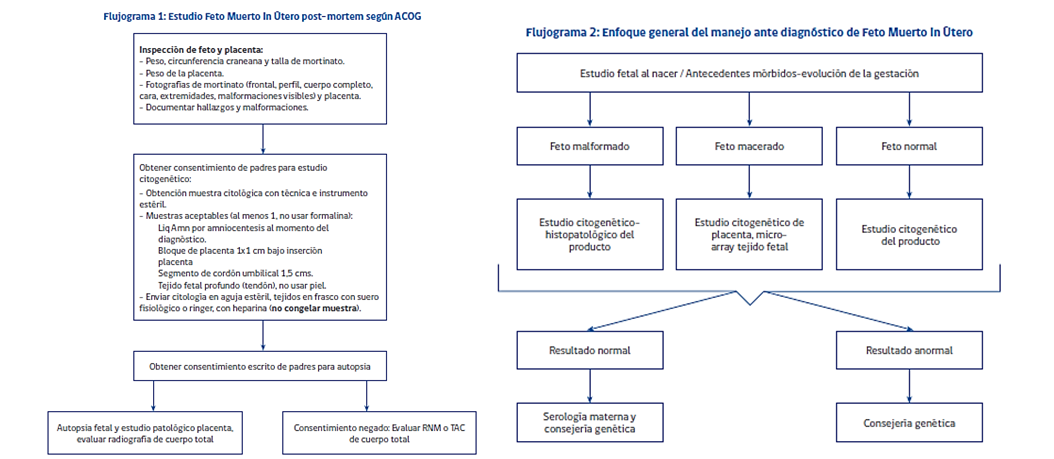
- Estudio de Laboratorio: según sospecha clínica.
Parto
La forma más aceptada de extraer el feto muerto in-útero es mediante la inducción del trabajo de parto. Con EG menor de 28 se prefiere el Misoprostol por sobre la oxitocina, debido a su alta tasa de éxito y baja prevalencia de complicaciones maternas, además de su alta efectividad y bajo costo. Sobre las 28 semanas se sigue la inducción según el protocolo convencional, la cesárea se reserva para cuando la vía vaginal este contraindicada.
En caso de usar Misoprostol se usan dosis de 200 – 400 mcg cada 4 a 6 horas vía vaginal.
Cuando está el antecedente de una cesárea anterior, el misoprostol se puede utilizar en EG<24 semanas, y se desaconseja su uso en >28 semanas por alto riesgo de rotura uterina. En caso de necesitar dilatación cervical el MINSAL recomienda usar entonces una sonda Foley.
Gestación Post- Muerte Fetal
En los países desarrollados la estrategia para disminuir la tasa de MF ha sido la identificación y tratamiento de los factores de riesgo.
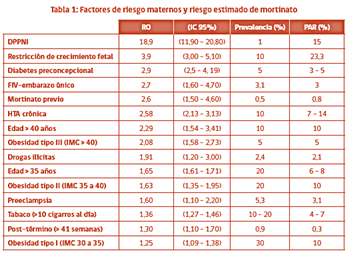
Manejo preconcepcional
El riesgo de recurrencia es distinto según la causa (muy importante averiguarla), sin embargo globalmente el riesgo de tener otra MF aumenta 2veces, lo que quiere decir que si bien la probabilidad de que el evento se repita no es alta (tranquilizador para los padres), requieren ser referidas a un centro de atención especializado
Un método importante es el consejo preconcepcional en poblaciones médicamente en riesgo, como DM, epilepsia, hipotiroidismo, HTA crónica y otras, sumado al manejo de los riesgos tratables y la reducción de:
- Peso preconcepcional
- Tabaquismo
- Ingesta de OH y Drogas
- Maternidad >35 años, especialmente >45. (poblacionalmente)

Manejo del embarazo
Debe hacerse un seguimiento ecográfico y de laboratorio muy exhaustivo.
- 1er Trimestre:
- Ecografía 11-14 con especial énfasis en:
- Riesgo de aneupleudías y estudio genético en casos con riesgo >= 1%.
- Ultrasonido de Arterias uterinas
- Laboratorio: b-hCG y PAPP-A
- Ecografía 11-14 con especial énfasis en:
- 2do Trimestre:
- Ecografía entre 20 – 24 sem con doppler arterias uterinas
- 3er Trimestre:
- Entre las 28 y 32 semanas se recomienda realizar una estimación del peso fetal para seguir la curva de crecimiento fetal y Doppler de la arteria umbilical.
Se estima que un porcentaje importante de las MFIU de origen desconocido serían RCIU que no se diagnostican con curvas poblacionales pero que si aparecen al usar curvas customizadas que integren el origen étnico y la talla y peso de los padres.
Desde las 32 semanas o una semana antes de la MF anterior, se recomienda realizar perfil biofísico y doppler umbilical en forma seriada, al menos una vez a la semana.
El momento de la interrupción no debería ser más allá de las 38 a 39 semanas, sin embargo, después las 34 y las 35 semanas se debe decidir si el riesgo de MFIU es mayor a los riesgos de la prematurez para tomar una decisión, para esto es necesario comprobar la madurez pulmonar del feto.
Las complicaciones maternas de la MFIU son raras, y se dan preferentemente con óbitos de más de 4 semanas. Se produce el “Sd de muerte fetal” que consiste en una CID por activación de la coagulación, producto del paso de tejido tromboplastínico a la circulación materna. También puede ocurrir embolía de líquido amniótico o complicación de la enfermedad materna.

Isoinmunización
La isoinmunización consiste en la producción, por parte de madre, de anticuerpos contra antígenos del feto, siendo la principal causa la isoinmunización Rh, donde la madre produce anticuerpos contra antigneos del grupo Rh (principalmente el D) de los GR del feto, generándole anemia y eventual hidrops y muerte fetal.
Otros antígenos susceptibles son los RH C, c, E y e.
Su incidencia ha disminuido en las últimas décadas, reportándose 1 a 6,8/ 1.000 RNV gracias a las estrategias de profilaxis implementadas.
fisiopatología
Las mujeres Rh (-) no poseen anticuerpos contra los antígenos (+) del sistema Rh de forma natural, pero los desarrollan (se demora por lo menos 2 semanas) cuando se exponen a ellos.
Lo más clásico es que una mujer embarazada entre en contacto con estos antígenos durante el parto de un hijo que sea Rh (+). Recordemos que el ser Rh (-) se debe a un gen recesivo, por lo que necesariamente para tener hijos Rh (+), el padre debe ser (+).
Sin embargo, una madre puede entrar en contacto con los antígenos de otras formas, desde el mismo feto por traumas, o por abortos previos, embarazos ectópicos, mola hidatidiforme, etc. Una vez que la madre entra en contacto, se activa el sistema inmune adaptativo que producirá anticuerpos contra estos antígenos, en lo que se denomina sensibilización.
Entonces, una mujer sensibilizada, posee anticuerpos (tipo IgG) contra los nombrados antígenos. El riesgo es que, en un embarazo de un hijo Rh(+), estos anticuerpos atraviesen la placenta y se unan a los eritrocitos fetales, que serán destruidos en el sistema retículo endotelial, determinando anemia del feto y posible hidrops y/o muerte fetal.
Diagnóstico de incompatibilidad
En toda mujer embarazada debe determinarse su grupo ABO y Rh en el primer control antenatal. En caso de que sean Rh (-) se debe determinar el grupo Rh del padre, si este es Rh (-) la mujer puede ser considerada de bajo riesgo y puede mantener los controles habituales.
Si esto no ocurre, la mujer debe realizarse el Test de Coombs indirecto en cada trimestre para determinar si fue o no sensibilizada.
Test de Coombs Indirecto: se extrae suero de la madre, y se mezcla con sangre Rh (+). En caso de estar sensibilizada, en el suero hay anticuerpos que aglutinaran los GR de la sangre Rh(+) al agregar el reactivo de Coombs (ac antihumanos).
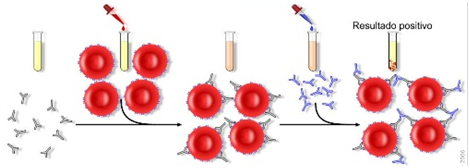
Diagnóstico de Anemia Fetal
Se recomienda realizar ecografía doppler de la arteria cerebral media (ACM) en todas las mujeres con títulos de anticuerpos ≥1:64, para detectar anemias moderadas a severas.
Esta prueba se basa en que al existir anemia, disminuye la viscosidad de la sangre, con lo que aumenta la velocidad, que es medible mediante doppler en la ACM.
Se recomienda que esta técnica sea realizada por un profesional acreditado en medicina materno fetal ya que requiere expertiz para ser realizada. Son requisitos para realizar una medición confiable.
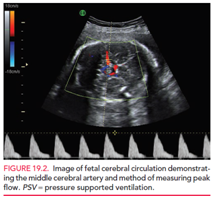
- Corte axial del cerebro que incluye al tálamo y septum pellucidum.
- Visualización del polígono de Willis, se mide en el tercio proximal de la ACM
- Angulo de isonacion cercano a 0°
- Se mide el punto más alto de la onda espectral
- Evitar compresión excesiva del cráneo fetal.
En Europa realizan cordocentesis y Test de Coombs directo cuando hay titulos ≥ 1:32.
Antes el diagnóstico se hacía mediante amniocentesis y espectrofotometría del LA, pero se ha dejado de lado porque era muy invasivo y el doppler de la ACM tiene buena sensibilidad.
Prevención de isoinmunización
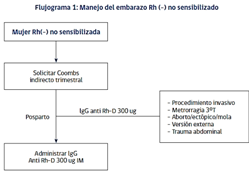
Se basa en la neutralización de los antígenos fetales (Rh D) antes de que la madre logre montar su propia respuesta inmune.
Esto se logra mediante la inyección intramuscular de 300ug de Inmunoglobulina anti Rh-D, dentro de las 72 horas post parto.
Algunos profesionales se refieren a ella como la “vacuna”, pero en realidad no lo es, una vacuna induce una respuesta inmunológica adaptativa en quien la recibe, y en este caso es todo lo contrario.
Se entrega además la Ig anti-D cuando exista riesgo de hemorragia feto materna, que pudiera generar la sensibilización. Se da una dosis de refuerzo a las 40 semanas si la primera dosis fue hace más de 12 semanas.
Son causas de hemorragia feto-materna:
- Aborto espontáneo o provocado
- No es necesario en abortos <12 semanas, sin instrumentalización ni uso PGs
- Embarazo ectópico
- Mola hidatidiforme incompleta
- Procedimientos invasivos
- Amniocentesis
- Biopsia de Vellosidades Coriales
- Cordocentesis
- Metrorragia del 3er trimestre
- DPPNI
- Vasa previa
- Placenta acreta
- Versión cefálica externa
- Trauma abdominal.
En casos de trauma placentario o disrupción de la interfase feto materna, por su asociación a hemorragias feto maternas extensas, se recomienda la determinación de células fetales en sangre materna mediante el test de Kleihauer.
Manejo de embarazo con mujer sensibilizada
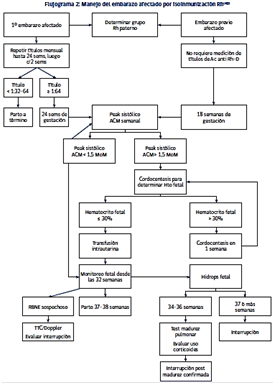
Se recomienda que en la embarazada en la que se demostró su primera sensibilización, se determinen los títulos de anticuerpos de forma mensual, y aquellas con títulos ≥1:64 deben ser evaluadas con Doppler de la ACM semanalmente.
En mujeres con antecedentes de embarazo previo en el que haya cursado con isoinmunización Rh, si no ha cambiado de pareja (o la nueva pareja es Rh (+)), debe ser evaluada con doppler de ACM desde la semana 18, semanalmente. (Sin medir títulos).
Si el doppler tiene un peak sistólico >1,5 MoM, se debe indicar una cordocentesis para medir el hematocrito y la primera transfusión fetal en caso de que este sea menor al 30%, usando sangre O Rh (-), irradiada y sin leucocitos, con un hematocrito de 75%.
Se transfunde un volumen estimado por la fórmula EPF (estimación de Peso fetal) x 0,02, con lo que se espera subir el hematocrito un 10% y conseguir una Hb >14g/dL.
Esta transfusión se debe hacer intravascular, en la inserción placentaria del cordón.

Después de la segunda transfusión, la tercera (y subsiguientes) debe indicarse estimando la pérdida diaria de hemoglobina, que es alrededor de 0,3g/dL diario.
El momento del parto debe ser, idealmente, entre las 37 y 38 semanas, o entre las 34 y 35 si hay hídrops fetal, o antes si se demuestra sufrimiento fetal (RBNE + TTC/Doppler), una vez comprobada (o inducida) la madurez pulmonar. La vía del parto debe ser elegida según criterios obstétricos.
Un RN que recibió trasfusiones intraplacentarias no presenta un riesgo agregado de tener secuelas neurológicas a largo plazo.
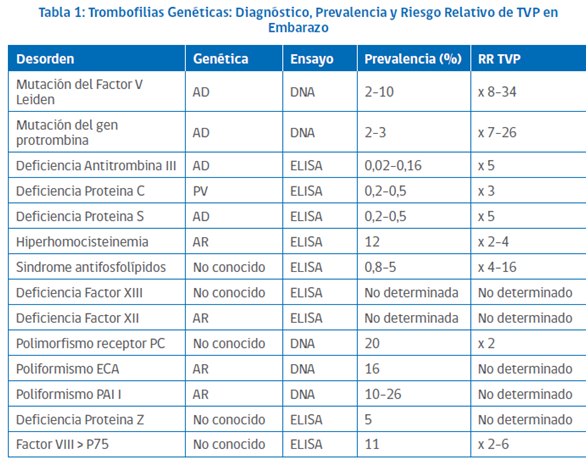
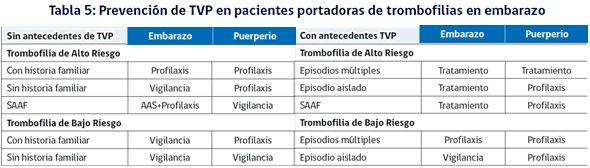
Trombofilias

Son condiciones congénitas o adquiridas que predisponen a trombosis venosas o arteriales a edades más tempranas, o en territorios inhabituales.
Más que una enfermedad, son factores de riesgo para presentar complicaciones trombóticas, principalmente venosas (TVP y TEP), más aun en el embarazo, y además se asocian con muerte fetal, aborto recurrente, preeclampsia severa, RCIU y DPPNI, presuntamente por micro o macrotrombosis fetoplacentarias. El riesgo aumenta entre 1,5 a 5 veces, dependiendo de la trombofilia.
El embarazo de por si se considera una condición protrombótica, por aumento en la síntesis hepática de factores de la coagulación, disminución de los factores anticoagulantes y más éstasis venoso.
En general 1 de cada 1.000 embarazos tienen complicaciones trombóticas, aumentando el riesgo de trombosis 5 a 10 veces, y 15 a 35 veces en el embarazo. Este riesgo aumenta cuando hay factores asociados, como cirugías, reposo prolongado, tabaquismo y aún más en presencia de trombofilias.
Estas condiciones deben sospecharse en mujeres que hayan sufrido eventos trombóticos sin factores precipitantes externos, especialmente en personas jóvenes (< 40 a 50 años), ante eventos recurrentes o severos, o con fuerte historia de enfermedad trombótica (más aún si fue cuando jóvenes)
En estas personas (y no en la población general), está indicado el estudio de trombofilias, que generalmente se hace mediante ensayos inmunológicos, funcionales o determinación de mutaciones (ver en Anexo), estos exámenes son de alto costo. Una condición aparte es el SAAF que será tratado en un apartado distinto.
El momento ideal para realizar el estudio no es el embarazo, ni el puerperio. Se recomienda hacerlo al menos 6 semanas post parto y sin el uso de anticoagulantes.
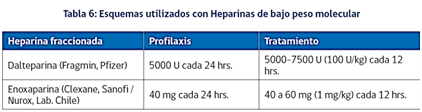
El tratamiento se realiza con Heparinas de bajo peso molecular (HBPM) que no atraviesan la placenta, y se puede revertir en caso de urgencias usando plasma fresco congelado. Estos fármacos pueden indicarse en dosis profilácticas o terapéuticas, según los antecedentes trombóticos y el riesgo de cada condición.
Para el parto el tratamiento se debe suspender al menos 24 horas, o 12 horas si es solo profilaxis. En caso de urgencia se da PFC y anestesia general. Posteriormente el esquema se reanuda a las 6 horas si fue parto vaginal o 12 horas después si fue cesárea.
Durante el puerperio se puede cambiar a TACO (excepto déficit de Prot C y S), buscando un INR entre 2 y 3
El embarazo debe ser manejado por un equipo multidisciplinario que incluya al obstetra medicina materno fetal y el hematólogo. Debe vigilarse la aparición de trombocitopenia (RAM de HPBM) y el bienestar materno y fetal. Si existe historia reproductiva adversa el embarazo debe interrumpirse antes de las 39 semanas.
Síndrome Antifosfolípidos (SAF)

El síndrome anti fosfolípido es una enfermedad autoinmune, que puede presentarse por sí solo (primario) o acompañando a otra enfermedad reumatológica, especialmente al LES.
Se distingue de las otras trombofilias porque para su diagnóstico si requiere elementos clínicos.
El tratamiento se realiza con Heparina y aspirina (100mg/día VO) durante el todo el embarazo, y con TACO en el puerperio, con lo que se reduce el riesgo de un nuevo aborto en un 54%.
hidrops fetal
Se define como un edema subcutáneo generalizado que se visualiza en la ecografía como un espesor de la piel >5mm o presencia de líquido en al menos 2 cavidades (pericardio, ascitis o pleura). A pesar de ser poco frecuente, su mortalidad es elevada, entre 50 a 95% según etiología.
Clásicamente se ha dividido en dos formas, la inmune, por isoinmunización, y la no inmune, que puede ser por distintas causas como cardiopatías, alteraciones del ritmo, infecciones, alteraciones metabólicas, etc. Actualmente, por la profilaxis de la isoinmunización Rh, las causas no inmunes serían responsables del 87% de los hidrops.
Hidrops Inmune
Ver isoinmunización
Hidrops No Inmune
Actualmente el diagnóstico de hidrops suele hacerse antenatalmente, debido al alto riesgo se debe hacer una búsqueda exhaustiva de la causa, para intervenir de forma de salvarle la vida al feto.
La ecografía además de diagnóstica puede ser útil al pesquisar malformaciones cardiacas, alteraciones del ritmo o presencia de tumores como teratomas o hemangiomas que estén causando insuficiencia cardiaca.
Mediante el estudio, se podría identificar la causa y con ella el pronóstico y manejo, el cual puede ser:
- Enfermedades cuyo tratamiento es inútil
- Enfermedades que son susceptibles a intervención en el periodo intrauterino
- Enfermedades cuyo tratamiento debe ser al momento del parto
La batería de exámenes (2005) es la siguiente.
Si bien puede responder a múltiples etiologías, se detallaran algunas de las más frecuentes.
Cardiopatías
Son las causas más diagnosticadas de hidrops, producen edema por insuficiencia cardiaca y dentro de este grupo las más frecuentes son las alteraciones del ritmo.
Bradiarritmias
Las que más frecuentemente causan hidrops son la extrasístole auricular con bloqueo y el bloqueo atrio ventricular completo congénito (BAVCC), este ultimo suele aparecer en contexto de cardiopatía congénita o por mesenquimopatía materna (anti-ro y anti-la), suele aparecer entre las semanas 16 y 24. Su tratamiento es con corticoides pero es controversial.
Taquiarritmias
La taquicardia supra ventricular es la más frecuente, y siempre debe tratarse, idealmente antes del hidrops con digoxina (a través de la madre). En caso de no responder existen otros esquemas farmacológicos alternativos.
Parvovirus B19
Afecta característicamente a los niños produciendo 5ta enfermedad, en el feto puede producir hidrops por compromiso hematopoyético o miocarditis. Se la atribuye el 10% de los hidrops fetales no inmunes.
La transmisión vertical ocurre en un 25 a un 33% de las veces, pero solo un 5% llega a generar hidrops fetal. El diagnóstico se hace con IgM en sangre materna desde los 12 días de inoculación (presente hasta 10 meses). Si hay solo IgG indica infección previa.
Cuando una embarazad es expuesta se le debe buscar la IgM, en caso de ser positiva debe hacerse ecografías seriadas cada 1 a 2 semanas para pesquisar el hidrops, en cuyo caso está indicada la transfusión sanguínea por cordocentesis. Hay estudios que muestran que el hidrops severo por esta sin tratamiento podría llevar a resolución espontanea con RNT sin secuelas (2005).
Mucopolisacardidosis VII (Sd de Sly)
Autosómica recesiva por déficit de beta glucoronidasa, en sus formas graves hay hidrops fetal y muerte temprana.
Talasemia
Déficit cualitativo de hemoglobina, con hemolisis acelerada. Hay un espectro clínico desde silente hasta grave anemia hemolítica intrauterina, que en la mayoría de los casos termina en MFIU.
Fuentes
- Guía Perinatal, MINSAL, 2015
- Manual Ginecología y Obstetricia, PUC, 2014
- Manual Obstetricia, HCUCH, 2005
Anexos
Tomás Pérez-Luco A.