Nivel de manejo del médico general: Diagnóstico Sospecha Tratamiento Inicial Seguimiento Derivar
Introducción
El carcinoma hepatocelular (o hepatocarcinoma, HC) es una proliferación celular malignas que se origina en las células hepáticas y representa el 80% a 90% de todos los tumores hepáticos malignos primarios (recordar que la patología maligna más frecuente en hígado es la de origen metastásico). Por otro lado, en torno a un 90% de estos cánceres se presentan en un hígado previamente enfermo, por lo que el paciente no sólo se ve sometido a la morbimortalidad propia de su enfermedad de base, sino también, a la que corresponde al HC y su tratamiento. Generalmente, a nivel mundial, esta hepatopatía crónica se deb a la infección por virus de la hepatitis B o C.
Epidemiología
Mundialmente, es el quinto cáncer en frecuencia diagnosticado en el adulto y la segunda causa de muerte por cáncer. El número de muertes por año debidas al HC es casi equivalente a la incidencia, por lo que la fatalidad se ve subestimada para esta agresiva patología.
En Chile no existen datos epidemiológicos precisos, justamente por ser una patología de muy baja prevalencia. Tanto es así, que en los datos demográficos y en aproximaciones descriptivas se utiliza el término “cáncer hepático” para referirse a este y otros cánceres primarios hepáticos, y tal vez también a uno que otro secundario.
La incidencia y muerte por este cáncer se encuentran en aumento en muchas partes del mundo, incluyendo Norte América, Latino América, y Europa central. En este mismo contexto, se presenta con una gran variabilidad geográfica y étnica, siendo África y el sudeste asiático (Japón y China principalmente) las zonas con mayor incidencia y prevalencia. El continente americano en general y la mayor parte del continente europeo son zonas de baja incidencia de este cáncer.
El género masculino tiene tres veces más riesgo que el género femenino de producir este cáncer. Esta diferencia se vuelve más evidente en las zonas del mundo con alta incidencia de HC.
La edad de presentación clásica se encuentra entre los 50 y 60 años de edad, sin embargo se ha observado que en el continente africano esta situación se aleja de la realidad mundial, presentando una edad promedio de aparición de la enfermedad a los 33 años.
Factores de Riesgo
A continuación se enumeran los factores de riesgo más importantes para desarrollar un HC. Dada la presencia de una condición presdisponente, el paciente debe ser seguido de manera de detectar precozmente un cáncer. Resulta destacable el hecho de que la enfermedad se puede presentar en pacientes sin factores de riesgo presentes.
- Infección crónica por VHB (sin importar la presencia de cirrosis)
- Infección crónica por VHC (sobretodo si coinfecta junto a VHB)
- Hemocromatosis hereditaria
- Hepatitis crónica o cirrosis por cualquier causa (incluye colangitis biliar primaria)
- Presencia de várices esofágicas
- Edad avanzada
- Hábito tabáquico
- Consumo habitual de alcohol etílico (sin especificar frecuencia ni dosis, se requieren más estudios)
- Elevación de GOT
- Historia familiar de HC
- Síndrome metabólico / Diabetes Mellitus
- Hígado graso no alcohólico (incluso sin cirrosis)
- Obesidad
- Déficit de alpha-1 antitripsina
- Porfiria aguda intermitente
- Cálculos biliares / colecistectomía por esa causa.
Si bien se ha investigado en torno a factores dietarios predisponentes como carnes rojas y grasas saturadas, estos no han demostrado incrementar el riesgo de presentar la enfermedad en discusión.
También se han descrito factores protectores como el uso de estatinas, factores dietarios como el consumo de omega 3, pescado, vegetales y vitamina E. Especial mención requiere el consumo de café, considerado como ingesta diaria de dos o más tazas, ya que ha presentado un gran valor protector, disminuyendo la incidencia total (tanto en pacientes con enfermedad hepática previa como sin enfermedad) en un 43%.
Clínica y Diagnóstico
Esta enfermedad suele ser insidiosa y asintomática, presentando sintomatología que se relaciona con la enfermedad hepática de base en la mayoría de los casos. La sospecha se presenta ante un paciente con cirrosis previamente compensada y que desarrolla una descompensación (ascitis, encefalopatía, ictericia o sangrado variceal). Algunos pacientes podrían presentarse con dolor abdominal leve a moderado en hemiabdomen superior, pérdida de peso, saciedad precoz o masa palpable en abdomen superior, todos los cuales son indicadores de enfermedad avanzada.
En ocasiones el paciente se puede presentar con un síndrome paraneoplásico que se manifiesta como hipoglicemia, eritrocitosis, hipercalcemia o diarrea acuosa severa.
El examen físico suele revelar la enfermedad hepática de base (esplenomegalia, ascitis, ictericia, cirrosis descompensada). Se puede encontrar hepatomegalia o un soplo en hipocondrio derecho.
El laboratorio suele ser inespecífico, respondiendo principalmente a la patología de base, usualmente cirrosis. Se podrían encontrar trombocitopenia, hipoalbuminemia, hiperbilirrubinemia e hipoprotrombinemia. Usualmente estos pacientes se encuentran además levemente anémicos y podrían presentar alteraciones hidroelectrolíticas (por mal manejo del consumo de agua libre o uso de diuréticos). Las aminotransferasas séricas, fosfatasas alcalinas y GGT se encuentran usualmente elevadas y tiene poco valor en este contexto.
La única forma de hacer un diagnóstico efectivo y precoz es ingresando a los pacientes en riesgo en programas de vigilancia con ecografía cada 6 meses. En caso de no encontrarse el paciente con este seguimiento preventivo, podríamos hacer el diagnóstico ante un contexto de enfermedad hepática previa con alphafetoproteína (AFP) elevada. Ante esto, se suele continuar el estudio con imágenes (TAC, RNM). En los pacientes cirróticos cualquier nódulo sólido dominante que no es claramente un hemangioma debería ser considerado HC a menos que se demuestre lo contrario. Si la lesión es hipervascular, tiene intensidad aumentada en T2, muestra invasión venosa o se asocia a AFP elevada, el diagnóstico es casi seguro.
Si las imágenes iniciales no llevan al diagnóstico definitivo, una imágen con otra técnica o seguimiento el seguimiento imagenológico podría clarificar el diagnóstico; los nódulos displásicos permanecen estables típicamente, mientras que una lesión dominante y en crecimiento es más probable de resultar ser un HC. Hasta los nódulos estables requerirán seguimiento de cerca, dado que los nódulos displásicos se encuentran en alto riesgo de desarrollar un HC en el futuro.
En pacientes no cirróticos el diagnóstico de HC debería ser considerado ante cualquier masa hepática que no es claramente un hemangioma o hiperplasia nodular focal, especialmente si es hipervascular. En ausencia de las pruebas específicas para establecer el diagnóstico, una biopsia podría estar indicada.
Histopatología
Cuando en algún caso sea necesaria la toma de una biopsia para establecer el diagnóstico preciso y así determinar la conducta, esta puede ser realizada bajo visión ecográfica o por TAC. Las biopsias core dirigidas son más útiles que las biopsias con aguja fina, debido a la cantidad de tejido que se obtiene y la posibilidad de obtener parénquima hepático libre de enfermedad.
La apariencia histológica del HC puede variar desde lesiones bien diferenciadas (con hepatocitos individuales prácticamente idénticos a los normales) a lesiones pobremente diferenciadas que consisten en células tumorales gigantes, anaplásicas, multinucleadas y con núcleos prominentes. En los tumores grandes es común encontrar necrosis central.
En algunos casos se diagnostica displasia, más que carcinoma. La utilidad de clasificar los grados de displasia en varias categorías para predecir el riesgo de desarrollar HC se encuentra aún en debate.
Estadificación

Tratamiento
Generalmente, el diagnóstico del HC es en sus estadíos tardíos, y el promedio de sobrevivencia tras el diagnóstico es de entre 6 a 20 meses. A pesar de que el pilar central de la terapia es la resección quirúrgica, la mayoría de los pacientes no son elegibles por la extensión del tumor o por la disfunción hepática subyacente. Hay muchas otras modalidades de tratamiento, como lo son el trasplante hepático, ablación por radiofrecuencia, por microondas, por etanol percutáneo, o por ácido acético, quimioembolización transarterial, radioembolización, crioablación, terapia radiactiva, radioterapia estereotáxica, quimioterapia sistémica y terapias moleculares. La elección se encuentra sujeta a la extensión de la enfermedad y la severidad de la enfermedad hepática de base. Para pacientes con cirrosis, la clasificación Child-Pugh es la más utilizada para estratificar a los pacientes según su enfermedad de base.
El enfoque sugerido servirá, en muchos casos, para determinar la mejor conducta según el paciente individualizado, sin embargo podría no ser aplicable en todos los escenarios.
El uso de la etapificación TNM (AJCC/UICC) para determinar el tratamiento adecuado para cada paciente resulta dificultoso, dado que esta se vale de algunos hallazgos quirúrgicos para establecer el estadío correspondiente, y la cirugía es aplicable para un 5% de los pacientes aproximadamente.
Los pacientes médicos con enfermedad avanzada y que no son candidatos para resección o trasplante, pueden ser clasificados según el siguiente algoritmo de la BCLC (Barcelona Clinic of Liver Cancer), con precaución con los estadíos B y C, ya que algunos pacientes que se encuentren en estas categorías podrían ser candidatos a resección o trasplante.
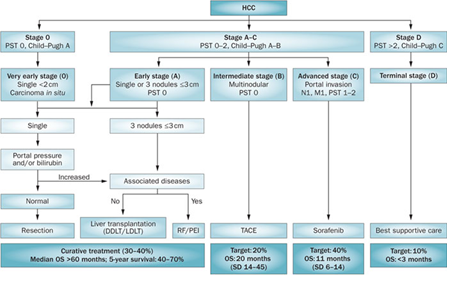 Se recomienda que los pacientes candidatos a resección quirúrgica sean clasificados según etapificación TNM.
Se recomienda que los pacientes candidatos a resección quirúrgica sean clasificados según etapificación TNM.
Posibilidades terapéuticas
a) Resección quirúrgica: La hepatectomía parcial potencialmente curativa es el tratamiento óptimo para el HC en los pacientes con reserva funcional hepática adecuada. La lesión ideal candidata para esta opción terapéutica es un nódulo solitario confinado al hígado que no muestra evidencia radiográfica de invasión a la vasculatura hepática, sin evidencia de hipertensión portal y función hepática conservada. La sobrevivencia a largo plazo alcanza un 40%, y un 90% a los 5 años. Si bien se plantea que el punto de corte para los candidatos a resección sean 5 cms, no existe un tamaño establecido para la indicación, aunque se sabe que a menor tamaño mejores son los resultados. Desde el estadío IIIB la enfermedad ya es considerada irresecable, sin embargo, podrían existir casos muy seleccionados en estadíos IIIB, IIIC y IVA que en centros especializados se plantearían como candidatos a resección.
b) Trasplante hepático: Prácticamente todos los pacientes que son considerados para el trasplante hepático son irresecables por el grado de disfunción hepática subyacente más que por la extensión del tumor, de hecho, el trasplante podría ser apropiado para pacientes con HC en etapas precoces y enfermedad hepática avanzada. El trasplante hepático ortotópico es una opción válida para pacientes con enfermedad hepática que no tolerarán la resección y que tienen un HC solitario menor de 5 cms o hasta tres lesiones separadas siendo la mayor de no más de 3 cms, sin presentar invasión vascular ni metástasis a linfonodos o a distancia.
Cuando estos criterios de selección son aplicados de manera estricta, se pueden obtener excelentes resultados en la sobrevivencia a tres – cuatro años y en sobrevivencia libre de recurrencias. La sobrevivencia de estos pacientes es comparable o levemente menor a la de los pacientes sometidos a trasplante por causas no malignas.
Los criterios de indicación para el trasplante hepático ortotópico, dada su estrechez, se encuentran actualmente en consideración con el intento de ampliarlos, sin embargo esto aún ha sido adoptado de forma universal.
Una gran desventaja del trasplante (sumándose a la necesidad de inmunosupresión y sus riesgos concomitantes) es el largo tiempo de espera por donadores de órganos. En Chile, los pacientes con este diagnóstico que cumplan los criterios para ser candidatos a trasplante se ingresan a una lista de espera, que avanza según orden de llegada. Dado que para el DHC se solicita un puntaje MELD mayor a 15, estos pacientes son asignados de inmediato con un MELD de 20, o el propio del paciente si tiene uno superior. Dado que los tiempos de espera pueden extenderse por meses, se podrían utilizar técnicas terapéuticas puente como quimioembolización transarterial (TACE), ablación radiofrecuencia (RFA) o hepatectomía parcial para que el paciente se mantenga dentro del criterio de selección.
Ya se está implementando la técnica con donantes vivos en algunas partes del mundo, sin embargo este enfoque es aún controversial.
c) Ablación por radiofrecuencia: (RFA) involucra la aplicación local de energía térmica en radiofrecuencia. Los iones que se encuentran en el tejido cercano al electrodo (que alterna corrientes) comienzan a moverse generando calor, lo cual eleva la temperatura por sobre los 60°C, resultando en necrosis alrededor del electrodo. Es una opción razonable para los pacientes que se encuentran con enfermedad irresecable y son candidatos a procedimientos dirigidos dada la presencia de enfermedad confinada al hígado. Los mejores resultados se han obtenido en tumores de menos de 4 cms. En pacientes cirróticos, solo considerarla en etapas Child-Pugh A ó B. Recordemos que también puede ser utilizada como puente para el trasplante. Puede utilizarse asociado a TACE, obteniéndose mejores resultados con este tratamiento combinado (se recomienda en tumores de 3-5 cms).
d) Ablación con etanol o ácido acético: se considera para pacientes con tumores pequeños, que no son candidatos para resección por el deterioro de su función hepática. La gran eficacia del RFA ha desplazado esta técnica en algunos centros. El ácido acético he demostrado menos efectos adversos que el etanol, con similares resultados respecto a la eficacia.
e) Embolización transarterial: (TACE) implica la inyección de un agente quimioterapéutico con o sin agente procoagulante en la arteria hepática. Nuevas técnicas incluyen la inyección de microesferas de polivinilo, que muestran resultados similares y menor toxicidad.Usado usualmente para el tratamiento de grandes tumores irresecables que no son candidatos a RFA y también como terapia puente para el trasplante.
f) Crioablación: es la aplicación de alternante de congelación-descongelación mediante el uso de una sonda especial insertada directamente en el tumor. Utilizada más frecuentemente en pacientes que, durante el intraoperatorio, son clasificados como irresecables. Puede ser preferible a RFA en situaciones donde hay una alta probabilidad de daño colateral térmico o si la lesión es periférica.
g) Radioterapia: tiene utilidada emergente en esta patología, aunque su rol en pacientes con HC irresecable queda áun por definir. El hepatocarcinoma es un tumor radiosensible, sin embargo, el tejido hepático también lo es. El hígado sólo puede tolerar aproximadamente 20 Gy, aunque nuevas técnicas que focalizan la radiación podrían permitir la entrega de hasta 100 Gy.
h) Radioembolización: con isótopos radiactivos vía arteria hepática. La selección de los pacientes candidatos a este procedimiento requiere la evaluación e indicación por un equipo multidisciplinario. Tiene un relativo menor potencial tóxico, potencial para tratar pacientes con alta carga tumoral y relativamente pocos efectos adversos, comparada con otras terapias locales. Se encuentra limitado por su alto costo, restricciones anatómicas, además, TACE tiene mejores resultados en torno a la necrosis tumoral obtenida. Esta técnica aún se encuentra en estudio, cada vez más validada para su uso en el hepatocarcinoma.
En los pacientes con enfermedad avanzada se puede utilizar el Sorafenib (inhibidor de tirosin-kinasa multiobjetivo), con el que se han obtenido buenos resultados, con mejor calidad de vida y mayor sobrevida en estos pacientes.
La quimioterapia no es de uso rutinario, ya que el hepatocarcinoma es considerado un tumor resistente a esta. Por otra parte, no ha sido posible evaluar el beneficio en la sobrevida ya que los pacientes suelen fallecer por causas no malignas que se relacionan con la enfermedad de base.
Vigilancia post-trasplante
Se debe llevar a cabo en todos los pacientes, ya que la enfermedad puede presentar recurrencia. No existe un consenso en torno al abordaje óptimo para la vigilancia postratamiento. La National Comprehensive Cancer Network (NCCN) sugiere seguimiento imagenológico cada tres a seis meses por dos años, luego anual, además de AFP sérica (si se encontraba elevada inicialmente) cada tres meses por dos años y luego cada seis meses.

