Drogas Vasoactivas
Diego Sepúlveda V.
Introducción
Las drogas vasoactivas (DVA) engloban una gran categoría de fármacos con funciones vasopresoras e inótropas. Un vasopresor es aquel que induce vasoconstricción con la consecuente elevación de la Presión Arterial Media (PAM). Los inótropos incrementan la contractilidad cardíaca. Sin embargo, muchas DVA comparten ambas cualidades.
En general las DVA son usadas en el contexto de un paciente con shock y se indican cuando existe una PAM <60 mmHg o disminución > 30 mmHg de la Presión arterial sistólica (PAS) de base que resulte en una disfunción orgánica debido a hipoperfusión. No obstante, la reposición de volumen del compartimiento intravascular es primordial previo a la administración de DVA para maximizar su efectividad.
En la actualidad existen pocos estudios clínicos controlados que han comparado cada uno de estos agentes entre sí o que permitan recomendar uno por sobre otro. Por lo tanto, el uso masivo de estas drogas se basa en opinión de expertos, estudios con animales y el uso de metas, como la oxigenación tisular, como variables que permitan extrapolar pronósticos favorables.
En este capítulo se expondrán las características farmacodinámicas y principales usos clínicos de las DVA, previa revisión de conceptos fisiológicos y de cómo enfrentarse a un paciente con shock, sus diagnósticos diferenciales, manejo y monitorización inicial en la atención de urgencias.
Fisiología cardiovascular, regulación de la presión arterial y fisiología de receptores
La oxigenación tisular depende de tres variables fundamentales: El volumen circulante efectivo (VCE), gasto cardiaco (GC) y resistencia vascular sistémica (RVS) (1). Éstas deben permanecer en perfecto equilibrio, ya que nos podemos enfrentar a un paciente con un alto GC, un VCE levemente disminuido pero una RVS muy baja, como en el shock séptico, determinando esta última variable una perfusión tisular inadecuada. La relación de estas variables, determinarán la mantención de la Presión arterial (PA) en valores fisiológicos.
La volemia, entendiéndose como el volumen de líquido extracelular (intravascular + intersticial), depende básicamente de la cantidad de sodio del organismo. El VCE corresponde al volumen presente en el territorio intravascular arterial que perfunde y entrega O2 a los tejidos.
Tanto la PAM como la volemia son las principales variables reguladas para mantener la homeostasis cardiovascular, siendo los cambios en la PA más agudos. La volemia se normaliza mediante mecanismos de efecto más tardío, que para efectos de la siguiente revisión, no serán abordados.
Regulación de la Presión Arterial:
En cada tejido existe un flujo local el cual está determinado por la diferencia entre la presión arterial (PA) y la presión venosa (la cual tiende a mantenerse constante), además de la resistencia local del circuito, esta última variará para determinar los cambios en el flujo afectando directamente el radio de las arteriolas. Estos cambios de resistencia están determinados por factores locales (afectan a un territorio/órgano en particular) y factores generales (afectan a la mayoría de las arteriolas).
Los factores locales, como la autorregulación del flujo sanguíneo observada en el cerebro, corazón y riñones, resta de importancia cuando este mecanismo es sobrepasado por una hipotensión significativa.
Los factores generales que afectan la Resistencia Vascular Sistémica (RVS), son las modificaciones en el sistema nervioso autónomo (simpático y parasimpático) y sistema endocrino (catecolaminas principalmente), en respuesta a estímulos sensados por baro y quimiorreceptores ubicados en grandes vasos.
Al interpretar el flujo de manera sistémica, expresado como el GC, se desprende que depende tanto de la diferencia entre la PAM y la PAD (Presión aurícula derecha, despreciable por sus valores bajísimos) como de la RVS, expresado como GC = (PAM-PAD)/RVS. (2)
Las principales relaciones entre las variables mencionadas y la regulación de la PA se muestran en la Figura 1.
Figura 1. Regulación de la Presión Arterial Media
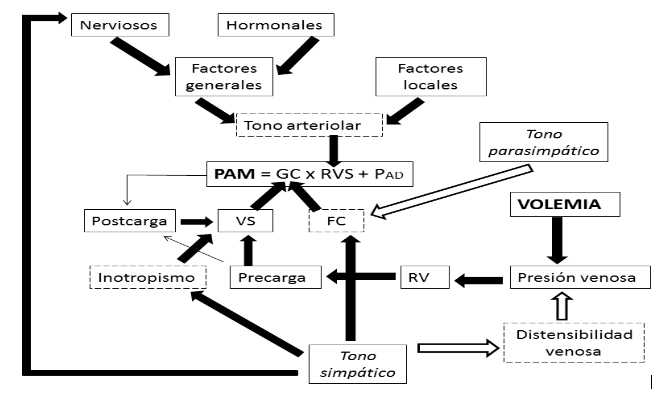
|
Cuando existe una disminución en la PA, principalmente son los quimiorreceptores presentes en el cuerpo carotideo y aórtico, y secundariamente los barorreceptores ubicados en los mismos vasos, los que enviarán el estímulo vía glosofaríngea y vagal a los centros cardiovasculares presentes en el tronco encefálico, desencadenando una respuesta autónoma que consta en la inhibición del parasimpático y la estimulación del simpático. Los efectos fisiológicos compensatorios derivados de una hipotensión se representan en la figura 2.
Figura 2. Respuesta fisiológica ante una disminución de la Presión arterial
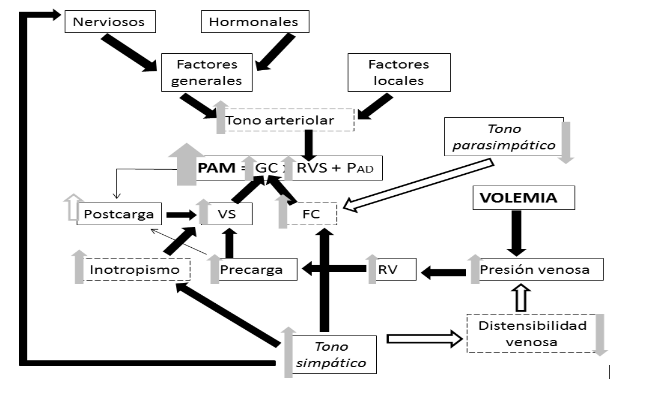
|
Las principales hormonas y neurotransmisores involucrados en el control de la PA son las catecolaminas y la ACh. Dentro de las catecolaminas destaca la norepinefrina (NE) la cual es secretada por terminaciones simpáticas generalmente (componente nervioso) y en menor medida desde la médula suprarrenal, y la epinefrina (Ep) la cual proviene en su totalidad desde la médula suprarrenal (componente hormonal). Las catecolaminas ejercen su acción en receptores adrenérgicos, destacando los subtipos alfa-1 (α1), beta-1 (β1), beta-2 (β2), así como también el receptor dopaminérgico (RD).
Receptores α1: Localizados en la pared de los vasos sanguíneos (músculo liso arteriolar y venas), su activación produce vasoconstricción significativa. En mayor proporción en tejido cutáneo, renal y esplácnico. También se encuentran en el corazón incrementando la duración de la contracción sin efectos cronótropos, sin relevancia clínica reconocida aún.
Receptores β: Los receptores β1 son los más comunes en el tejido cardiaco y su activación produce (1) aumento del inotropismo, (2) aumento del cronotropismo y dromotropismo, es decir, incrementa la frecuencia cardiaca y la conductibilidad atrioventricular, respectivamente y (3) efecto lusitrópico (relajación activa del tejido cardíaco, acorta diástole). Posee mínimo efecto vasoconstrictor. La estimulación de receptores β2 en vasos sanguíneos induce vasodilatación, mayoritariamente en músculo esquelético e hígado.
Receptores dopaminérgicos: Presentes en vasos renales, esplácnicos, coronarios y cerebrales, produciendo vasodilatación al estimularlos. Un segundo subtipo de RD causa vasoconstricción al inducir la liberación de NE.
Diagnóstico y clasificación del shock
Shock: Estado de hipoxia tisular y celular debido a una entrega reducida de oxígeno y/o aumento del consumo de oxígeno o su inadecuada utilización. Lo más común es que ocurra debido a una falla circulatoria manifestada como una hipotensión, aunque puede ser anunciado por otros signos vitales y la elevación del lactato sérico. Los efectos del shock son inicialmente reversibles pero pueden transformarse hacia la irreversibilidad rápidamente resultando en falla multiorgánica (FOM) y muerte, por lo que es primordial establecer la causa y manejarlo adecuadamente. Se habla de Shock indiferenciado cuando el shock es reconocido, pero la causa permanece incógnita (3).
Clasificación de Shock: Se reconocen cuatro grandes clasificaciones del shock, representados en la Tabla 1. Cabe destacar que los tipos de shock pueden sobreponerse en un mismo paciente.
Los hallazgos clínicos que nos hacen sospechar de un shock son: Hipotensión, taquicardia, oliguria, estado mental alterado, taquipnea, piel fría y/o cianótica, acidosis metabólica, hiperlactatemia.
Importante destacar que en las etapas precoces del shock puede no existir hipotensión, por lo que no es obligatoria su presencia para realizar el diagnóstico. La taquicardia es el signo más precoz y expresa compensación sistémica, manifestándose más en pacientes jóvenes. Los cambios cutáneos descritos, incluso piel moteada, hablan de una etapa tardía y ominosa del shock. La elevación del lactato puede estar acompañada o no de acidosis metabólica, se correlaciona con el desarrollo de shock y su mortalidad.
|
| TIPO DE SHOCK | SUBTIPO | CAUSAS |
| DISTRIBUTIVO | Séptico | Bacteriano, fúngico, viral, parasitario. |
| No séptico |
Inflamatorio (quemaduras, trauma, pancreatitis, post IAM, post PCR, etc) Drogas y toxinas (sobredosis vasodilatadores, rx. transfusionales, CO, etc) Endocrino (crisis adrenal, coma mixedematoso) |
|
| CARDIOGÉNICO | Cardiomiopático |
IAM (compromete > 40% Ventrículo izquierdo) Infarto extenso ventrículo derecho Exacerbación aguda de Insuficiencia cardiaca severa Espasmo cardiaco por isquemia prolongada (PCR, hipotensión, bypass cardiopulmonar). Shock séptico avanzado Miocarditis |
| Arritmogénico |
Taquiarritmias (FA, flutter, reentrada, TV) Bradiarritmias (BAV completo, BAV II grado Mobitz II) |
|
| Mecánico |
Insuficiencia aortica o mitral severa Ruptura valvular aguda Estenosis aortica crítica Ruptura aguda septum interventricular Ruptura aneurisma pared ventricular Mixoma atrial |
|
| HIPOVOLÉMICO | Hemorrágico | Trauma, sangrado GI, sangrado intra o postoperatorio, ruptura aortica, hemorragia postparto, etc… |
| No hemorrágico | Perdidas GI (diarrea, vómitos), perdidas por piel (heat stroke, quemaduras), perdidas renales (por drogas o diuresis osmótica, nefropatía perdedora de sal), perdida hacia espacios extravasculares o cavidades (posoperatorio, trauma, obstrucción intestinal, pancreatitis, etc) | |
| OBSTRUCTIVO | Vascular pulmonar |
TEP con sobrecarga de ventrículo derecho Hipertensión pulmonar severa |
| Mecánica |
Neumotórax a tensión Taponamiento cardiaco Pericarditis constrictiva |
|
Manejo inicial y monitorizacion
1. A,B,C:
- Estabilizar vía aérea, entregando oxigeno y/o ventilación mecánica cuando sea necesario. Cabe destacar que en pacientes hemodinámicamente inestables que se les realizará una secuencia de intubación rápida, se prefieren como inductores el etomidato o ketamina, en vez de propofol o midazolam que pueden empeorar la hipotensión.
- Obtener un acceso venoso con rapidez para iniciar a la brevedad una resucitación con fluidos, idealmente periférico de calibre 14 o 18 G. Sin embargo, en muchas situaciones es necesario instalar un catéter venoso central (CVC) que también sirve para administrar fluidos y/o productos sanguíneos, pero además es necesario para infusiones prolongadas de DVA, toma de exámenes de laboratorio y monitorización hemodinámica: presión venosa central (PVC) y saturación venosa central de oxigeno (SvO2%). No está de más recordar que la instalación de un CVC no debe retrasar la reanimación con fluidos si es que existe otro acceso venoso disponible.
- Estratificar riesgos: Al principio los pacientes se monitorizarán telemétricamente o se les hará un ECG en defecto, para descartar patologías que amenacen la vida que deban ser tratadas empíricamente en el momento.
- Evaluación diagnóstica: Historia clínica y examen físico acabados son primordiales. Obtener un ECG. Luego de estabilizado el paciente se puede realizar una evaluación de laboratorio temprana: Lactato sérico, pruebas de función renal y hepática, enzimas cardiacas, hemograma, pruebas de coagulación y dímero-D, y análisis de gases sanguíneos.
- Imágenes en pacientes con shock indiferenciado: Radiografía de tórax inicialmente. Otras imágenes pueden solicitarse según sospecha clínica. Actualmente se puede disponer de una evaluación ultrasonográfica al lado de la cama del paciente que siguen algoritmos como RUSH (rapid ultrasound in shock) o FOCUS (focused cardiac ultrasound).
- Cateterización de arteria pulmonar (CAP): Las medidas más agresivas de monitorización deben instaurarse precozmente frente a una falta de respuesta a una reanimación inicial estimada adecuada o en caso de pacientes que vuelven a comprometerse después de una reanimación inicial satisfactoria. Cuando aun no se ha demostrado la causa del shock, la CAP puede ser de ayuda pero no ha sido demostrado que su instalación mejore el pronóstico de los pacientes. Pueden beneficiarse pacientes en los cuales no se conoce el estado real de volemia a pesar de una resucitación con fluidos enérgica, aquellos con shock cardiogénico severo o en los que se sospecha que tengan una hipertensión pulmonar de base o un taponamiento cardiaco. Los principales parámetros medidos en la CAP son GC,RVS, presión de arteria pulmonar (Pap) y presión capilar pulmonar, presión atrio derecho y SvO2, creando un perfil aún más específico de cada tipo de shock (Tabla 2)
|
| Variable fisiológica | Precarga | Función de bomba | Postcarga | Perfusión tisular |
| Medida clínica | Pcp | GC | RVS | SvO2 |
| HIPOVOLÉMICO | ↔ (precoz) o ↓ (tardío) | ↔ (precoz) o ↓ (tardío) | ↑ | >65% (precoz) o <65% (tardío) |
| CARDIOGÉNICO | ↑ | ↓ | ↑ | <65% |
| DISTRIBUTIVO | ↔ (precoz) o ↓ (tardío) | ↑ o ↓ (ocasionalmente) | ↓ | >65% |
| OBSTRUCTIVO | ||||
| TEP, HTP, NTX a tensión | ↔ (precoz) o ↓ (tardío) | ↔ (precoz) o ↓ (tardío) | ↑ | >65% |
| Taponamiento cardíaco | ↑ | ↑ | <65% | |
|
g. Fluidos intravenosos: Tratamiento de elección en pacientes con hipotensión y shock indiferenciado. Se prefiere en bolos de 500 a 1000 cc hasta que la PA y la perfusión tisular sea adecuada o hasta que éstos fallen en aumentar la perfusión. Evitar una sobrecarga de volumen. El volumen es guiado por la sospecha etiológica del shock, por ejemplo, pacientes con shock séptico requieren entre 2 a 5 L. El tipo de fluidos a utilizar son clásicamente cristaloides, prefiriendo derivados sanguíneos en casos de shock hemorrágico.
h. ¿Se puede predecir qué pacientes responderán mejor a volumen vs DVA? Sí, actualmente gracias a técnicas de monitorización avanzada, se puede calcular el GC y VS, pero además se pueden extrapolar parámetros dinámicos derivados de estas mediciones como lo son la variación de volumen sistólico (VVS) y variación de presión de pulso (VPP), siendo esta última la que ha demostrado mayor especificidad en predecir qué pacientes responderán de mejor forma a la reanimación con fluidos, medida en la onda de pulso arterial (diferencia entre PAS y PAD). Las conclusiones se desprenden al observar la curva de Starling (Figura 3) entendiendo que un corazón depletado de volumen sanguíneo variará mucho su VS (y en consecuencia su presión de pulso) ante una leve modificación en su volumen final de diástole, que es equiparable al VCE; por lo tanto, el paciente se verá beneficiado de una terapia con fluidos más que con DVA en la zona de mayor pendiente de la curva de Starling, es decir, donde exista mayor VVS (4).
Se han establecido valores de corte para VPP y así guiar conducta. (Tabla 3)
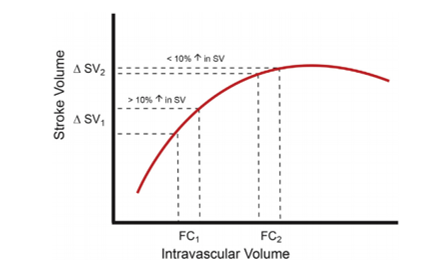
Figura 3. Optimización del volumen sistólico según curva de Frank-Starling
|
||
|
| VPP | Pacientes (%) | Respondedores (%) |
| VPP < 9% | 159 (38%) | 18 (11%) |
| VPP 9 – 13% | 98 (24%) | 49 (50%) |
| VPP > 13% | 156 (38%) | 142 (91%) |
|
Una vez comprendida la fisiología de la regulación de la PAM, la fisiopatología detrás de cada tipo de shock y los pilares fundamentales de su tratamiento inicial; es necesario que abordemos el tema de DVA en profundidad.
Precauciones previo a indicar drogas vasoactivas
El uso de vasopresores e inótropos se guía por los siguientes conceptos fundamentales:
- Una droga, múltiples receptores: Se pueden esperar varios efectos al administrar una droga. Por ejemplo, la dobutamina incrementa el GC por activación β1, pero puede producir hipotensión al estimular receptores β2 en territorio vascular (5).
- Curva Dosis-Respuesta: Activación diferencial de receptores adrenérgicos según la dosis administrada. Dopamina es el ejemplo clásico.
- Efecto directo versus reflejo: Pueden existir efectos reflejos gatillados por la respuesta farmacológica. Por ejemplo, la NE produciría taquicardia si sólo tuviese estimulación β1, pero como además eleva la PAM por efecto α1, la respuesta refleja a la vasoconstricción es disminuir la FC, por lo que el resultado final puede ser una FC estable o incluso levemente más baja al usar la droga.
Cuestiones prácticas
- Reposición de volumen: La adecuada repleción de volumen intravascular, cuando el tiempo lo permita, es crucial previo a la iniciación de DVA, es decir, son inefectivas cuando coexiste hipovolemia. Los fluidos deben usarse con precaución en pacientes con edema pulmonar significativo debido a SDRA o insuficiencia cardiaca.
- Selección y dosis: La elección de la DVA debe basarse en la sospecha etiológica del shock. La dosis debe ser titulada para lograr una PA efectiva o una buena perfusión tisular evidenciada por la diuresis o estado mental. Si la dosis máxima de un primer agente es inadecuada, debería agregarse una segunda DVA. Si ambas son inefectivas, como en un shock séptico refractario, hay pocos estudios que avalen el uso de una tercera DVA.
- Vía de administración: Vasopresores e inótropos deben administrarse por un catéter venoso central (CVC) adecuadamente instalado, así hay una entrega más rápida de la droga al corazón para una distribución sistémica, eliminando el riesgo de una extravasación por vía periférica. Si el paciente no tiene CVC, se pueden administrar DVA por vía periférica mientras se prepara la instalación de un CVC.
- Taquifilaxis: La respuesta a las drogas puede disminuir en el tiempo debido a taquifilaxis, por eso las dosis deben ser ajustadas constantemente según metas y la condición del paciente.
- Efectos hemodinámicos: En un shock cardiogénico por ejemplo, al elevar la RVS se produce un aumento de la postcarga, esto lleva a un mayor trabajo cardiaco en un corazón ya dañado lo que potencialmente disminuye el GC. Algunos autores recomiendan conservar la RVS en 700-1000 dinasx seg/cm5 para evitar la postcarga excesiva. A pesar de esto, no existe consenso de acuerdo a un GC ideal. Algunos estudios que han apuntado a mantener un GC suprafisiológico de >4-4.5 L/min por m2 no han mostrado un beneficio consistente.
- Administración subcutánea de medicamentos: Pacientes críticos usualmente reciben medicamentos por esta vía, como heparina o insulina. La biodisponibilidad de estos medicamentos puede reducirse durante el tratamiento con DVA debido a la vasoconstricción cutánea. Se recomienda que en pacientes que requieran DVA se aumente la dosis de HBPM para lograr una adecuada tromboprofilaxis, o cambiar la ruta hacia una vía intravenosa.
- Reevaluación frecuente: Los pacientes pueden requerir una segunda droga si persiste inestable hemodinámicamente. No debe olvidarse evaluar la condición general del paciente y no obviar que una hipotensión persistente o progresiva se deba solo a un ajuste de dosis de DVA (Ver Tabla 1)
1. Agonistas adrenérgicos:
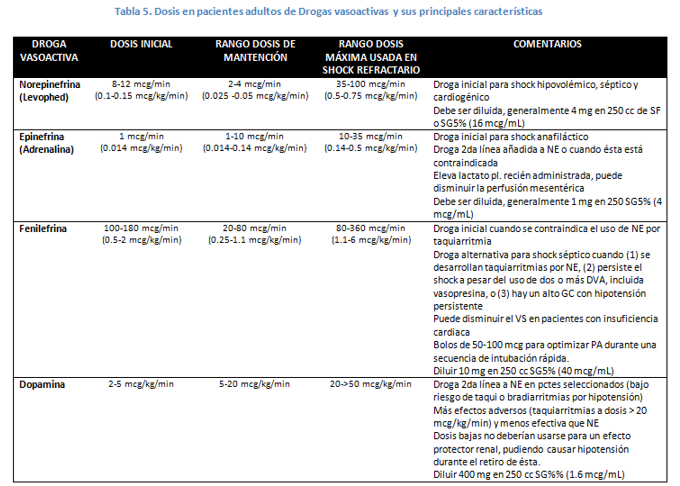
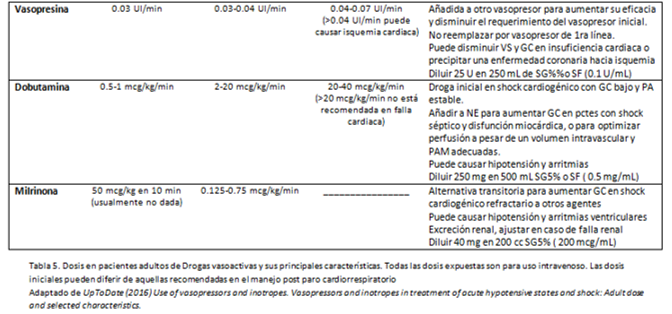
La fenilefrina, norepinefrina, dopamina y dobutamina son los vasopresores e inótropos más comúnmente usados en pacientes críticos. La variable selectividad de estos agentes por los receptores adrenérgicos se expresa en la Tabla 4. Las dosis y principales usos se muestran en la Tabla 5.
|
| DROGAS VASOACTIVAS | α1 | β1 | β2 | RD | Principales efectos clínicos |
| Fenilefrina | +++ | 0 | 0 | 0 | ↑↑ RVS, GC↔/↑ |
| Norepinefrina | +++ | ++ | 0 | 0 | ↑↑ RVS, GC↔/↑ |
| Epinefrina | +++ | +++ | ++ | 0 | ↑↑ GC, ↓ RVS (baja dosis)/ ↑ RVS (alta dosis) |
| Dopamina (mcg/kg/min) | |||||
| 0.5 – 2.0 | 0 | + | 0 | ++ | GC estable |
| 5.0 – 10.0 | + | ++ | 0 | ++ | ↑ GC, ↑ RVS |
| 10.0 – 20.0 | ++ | ++ | 0 | ++ | ↑↑ RVS |
| Dobutamina | 0/+ | +++ | ++ | 0 | ↑ GC, ↓ RVS |
| Isoproterenol | 0 | +++ | +++ | 0 | ↑ GC, ↓ RVS |
|
- NOREPINEFRINA: La NE (Levophed) actúa tanto en receptores α1 y β1, produciendo una potente vasoconstricción y un modesto incremento en el GC. Una bradicardia refleja ocurre con frecuencia ante el aumento de la PAM. Es la droga preferida para el tratamiento del shock séptico.
- FENILEFRINA: Posee un efecto alfa agonista puro por lo que produce vasoconstricción con mínimos cambios inótropos y cronótropos. La PAM aumenta por el incremento de la RVS. La droga es útil cuando existe hipotensión con una RVS < 700 dinasx seg/cm5 como ocurre en enfermedades neurológicas, hipotensión inducida por anestesia o en una sepsis hiperdinámica. Una desventaja potencial es que puede reducir el volumen sistólico (VS) por lo que su uso es reservado para pacientes en que se contraindica NE debido a arritmias o que ya han fallado con otras terapias. Aunque la elevación de la RVS aumenta la postcarga, muchos estudios documentan que el GC se mantiene e incluso aumenta en pacientes sin una cardiopatía preexistente. La droga está contraindicada si la RVS es > 1200 dinas x seg/cm5.
- EPINEFRINA: La Ep (adrenalina) tiene un potente efecto β1 y moderado a nivel α1 y β2. Clínicamente, bajas dosis de Ep incrementan el GC por el efecto inótropo y cronótropo positivo del receptor β1, mientras que la vasoconstricción por estimulación α1 es a menudo contrarrestada por la vasodilatación mediada por estimulación β2. Esto resulta en un aumento del GC con RVS disminuida y efectos variables sobre la PAM. Sin embargo, a altas dosis de Ep predomina el efecto alfa-constrictor produciendo tanto una elevación de la RVS como del GC. El uso de Ep se observa en el tratamiento de anafilaxia, como un agente de segunda línea (luego de NE) en shock séptico y para manejo de la hipotensión posterior a un bypass de arteria coronaria. Otras desventajas de la Ep incluyen arritmias (efecto β1) y vasoconstricción esplácnica, el grado de esta última parece ser mayor con Ep que con otras DVA con dosis equipotentes en pacientes con shock severo.
- EFEDRINA: Similar a la Ep, la efedrina actúa principalmente en receptores α y β adrenérgicos, pero con menos potencia. Su uso es inusual excepto en el escenario de hipotensión inducida por anestesia.
- DOPAMINA: Tiene una variedad de efectos dependiendo del rango de dosis administrada. Es a menudo usada como segunda línea (luego de NE) en pacientes con bradicardia relativa o absoluta y con riesgo bajo de taquiarritmias. La administración basada por peso produce efectos variables que se describen a continuación:
- Dosis 1 – 2 mcg/kg/min, la dopamina actúa principalmente en RD tipo 1 en los lechos vasculares renales, mesentéricos, cerebrales y coronarios, resultando en una vasodilatación selectiva. Algunos reportes sugieren que la dopamina aumenta la diuresis por incremento del flujo plasmático renal y la VFG, y natriuresis por inhibición de la aldosterona y el transporte de sodio en el túbulo renal. Aun así, no está claro que estos efectos clínicos sean significativos, incluso algunos pacientes pueden presentar hipotensión con estas dosis de dopamina.
- Dosis 5 – 10 mcg/kg/min, la dopamina estimula receptores β1 aumentando el GC, generalmente por mayor VS ya que tiene efectos variables en la FC. Dosis entre 2 y 5 mcg/kg/min tienen efectos hemodinámicos variables, puede ocurrir una vasodilatación que es compensada por el mayor VS, produciendo leves cambios en la PAM, que si se le suma el efecto leve α1, en suma podría elevar este parámetro.
- Dosis > 10 mcg/kg/min, la dopamina estimula predominantemente receptores α1, produciendo un aumento de la RVS. Sin embargo, el efecto α1 de la dopamina es más débil que el de la NE y la estimulación β1 con dosis > 2 mcg/kg/min con dopamina puede resultar en arritmias dosis dependiente.
En términos prácticos, el hecho de que la dopamina tenga efectos dosis-dependiente quiere decir que el cambiar la dosis de la droga es similar a cambiarla por otra DVA. Por el contrario, el simple aumento de la dosis de dopamina sin ser consciente de las diferentes poblaciones de receptores activos, puede causar resultados adversos.
El rango de dosis usual de dopamina es de 2 a 20 mcg/kg/min. Cuando es usada en insuficiencia cardiaca se recomienda comenzar con dosis de 2 mcg/kg/min con posterior ajuste según los efectos fisiológicos deseados.
f. DOBUTAMINA: No es un vasopresor, es un inótropo que causa vasodilatación. El efecto β1 predominante incrementa la inotropía y cronotropía reduciendo la presión de llenado ventricular. En pacientes con falla cardiaca esto resulta en una reducción de la actividad simpática cardiaca. Por otro lado, la mínima estimulación α1 y β2 resultan en una vasodilatación total, complementada con la vasodilatación refleja por aumento del GC. El efecto neto es un aumento del GC con disminución de la RVS, con o sin una reducción leve de la PA.
* La dobutamina es usada frecuentemente en shock cardiogénico severo o insuficiencia cardíaca aguda refractaria a tratamiento médico. No debiese usarse en sepsis por el riesgo de hipotensión. La dobutamina no vasodilata selectivamente los vasos renales como la dopamina a bajas dosis.
Contraindicaciones e Interacciones de agonistas adrenérgicos:
- En pacientes con shock cardiogenico, la NE es preferida por sobre la dopamina como vasopresor de primera línea ya que un estudio demostró mayor mortalidad en pacientes que recibieron dopamina en vez de NE. Además, las arritmias fueron más frecuentes en el grupo donde se utilizó dopamina.
- Pacientes con feocromocitoma están en riesgo de una estimulación autonómica excesiva al usar agentes vasopresores adrenérgicos.
- La dobutamina está contraindicada en pacientes con estenosis subaórtica hipertrófica idiopática.
- Pacientes usuarios de IMAOs son extremadamente sensibles al efecto de vasopresores, y por lo tanto, requieren de menores dosis
2. Vasopresina y análogos:
La vasopresina u hormona antidiurética (ADH) es usada para el manejo de la diabetes insípida y el sangrado por varices esofágicas, pero además puede ayudar en el manejo del shock distributivo. Aunque su rol preciso en este tipo de shock queda por definir, es usado generalmente como agente de segunda línea, particularmente en shock séptico o shock anafiláctico que no responde a epinefrina. También es usada a veces para reducir la dosis del agente usado de primera línea. La Terlipresina, un análogo de vasopresina, ha sido evaluada en pacientes con shock distributivo.
Los efectos de la vasopresina y terlipresina en el shock por vasodilatación (generalmente shock séptico) fueron evaluados en una revisión sistemática concluyendo que no había mejora significativa a corto plazo de la mortalidad entre pacientes que recibieron vasopresina o terlipresina. Sin embargo, los pacientes que recibieron vasopresina o terlipresina requirieron menos dosis de NE.
Los efectos de la vasopresina pueden ser dosis dependiente, valores > 0.03 UI/min han sido asociadas con isquemia coronaria, mesentérica y cutánea, y es evitada a menos que no pueda obtenerse una PAM adecuada con otras DVA. La hipotensión de rebote es común luego de retirar la vasopresina. Otros efectos adversos incluyen la hiponatremia y vasoconstricción pulmonar. Vasopresina y terlipresina tienen perfil similar de efectos adversos.
3. Agentes no adrenérgicos:
- Inhibidores de la Fosfodiesterasa (IPDE): Inamrinona (conocida como marinona) y milrinona son drogas no adrenérgicas con efectos inotrópicos y vasodilatadores. De muchas formas sus efectos son similares a los de la dobutamina pero con una menor incidencia de arritmias. Los IPDE son usados a menudo para tratar a pacientes con insuficiencia cardiaca severa o falla cardiaca refractaria a tratamiento médico, pero sus propiedades vasodilatadoras limitan su uso en pacientes con hipotensión.
- Inhibidores de NOS: Una sobreproducción de oxido nítrico parece jugar un rol en la vasodilatación inducida por sepsis. La N-monometil.L-arginina (L-NMMA) ha demostrado, en estudios de sepsis, un efecto dosis-dependiente de incremento de RVS. Sin embargo, el GC y la FC disminuyen, incluso cuando los pacientes son tratados concomitantemente con NE o Ep. El incremento en la RVS tienen a contrarrestar la caída de GC, por lo que la PAM es mínimamente aumentada. Su utilidad clínica persiste poco clara.
Complicaciones
Los vasopresores e inotrópicos tienen el potencial de causar complicaciones significativas, además de poseer varias interacciones con otras drogas.
- Hipoperfusión: Una vasoconstricción excesiva (> 1300 dinas x seg/cm5) en respuesta a la hipotensión y a los vasopresores puede producir una perfusión inadecuada a las extremidades, órganos mesentéricos o riñones. Ocurre en pacientes que tienen inadecuado GC o tuvieron una resucitación con fluidos inapropiada.
Los hallazgos iniciales son cambios en la piel de la punta de los dedos de manos o pies, de color oscuro, que puede progresar a una necrosis franca con autoamputación digital. El compromiso vascular renal puede llevar a insuficiencia renal aguda y oliguria, mientras que pacientes con EAO crónica de base pueden desarrollar isquemia aguda de la extremidad. Una inadecuada perfusión mesentérica incrementa el riesgo de gastritis, shock hepático, isquemia intestinal o traslocación de flora intestinal. A pesar de estas consideraciones, el mantener la PAM con vasopresores parece ser lo más efectivo en mantener el flujo sanguíneo renal y mesentérico que permitir que la PAM disminuya. El mantener la PAM con vasopresores puede ser crucial en salvar la vida del paciente a pesar de una hipoperfusión localizada. - Disrritmias: Se producen vía estimulación potente de receptores β1. Esto incrementa el riesgo de taquicardia sinusal (la más frecuente), fibrilación auricular (potencialmente con mayor conducción por NAV y una respuesta ventricular rápida en consecuencia), taquicardia de re-entrada NAV o taquicardias ventriculares.
Una adecuada volemización podría minimizar la frecuencia y severidad de estas arritmias. A pesar de esto, las disrritmias a menudo limitan la dosis de la droga y es necesario cambiar a otra DVA con menos efecto β1. Ya fue mencionado que comparando dopamina con NE, se demostró mayor incidencia de arritmias con la primera. - Isquemia miocárdica: El efecto cronótropo e inótropo positivo de la beta-estimulación produce un aumento en el consumo de O2 miocárdico. Mientras que usualmente hay vasodilatación coronaria en respuesta al uso de vasopresores, la perfusión puede persistir inadecuada para suplir la elevada demanda de oxigeno miocárdico.
Se recomienda realizar un ECG diario a pacientes que requieran DVA para pesquisar isquemia oculta, y evitar taquicardias excesivas (las coronarias no se alcanzan a perfundir bien en diástoles tan cortas). - Efectos locales: La extravasación de DVA en el tejido conectivo circundante puede llevar a una excesiva vasoconstricción local con necrosis cutánea consecuente. Para evitar esta complicación, las DVA deben ser administradas por un CVC cuando sea posible. Si ocurre infiltración, el tratamiento local con fentolamina (5-10 mg en 10 mL de suero fisiológico) inyectada vía subcutánea puede minimizar la vasoconstricción local.
- Hiperglicemia: Puede ocurrir debido a la inhibición de la secreción de insulina. La magnitud de ésta es leve y es más pronunciada con NE y epinefrina que con dopamina. La monitorización de la glicemia en pacientes con DVA puede prevenir complicaciones de una hiperglicemia no tratada.
Controversias actuales
Grandes controversias existen de acuerdo al uso de DVA en pacientes en estado crítico, al igual que ha sido difícil realizar estudios en poblaciones estandarizadas de pacientes dado la diversidad de definiciones sobre un proceso evolutivo como lo es SIRS, sepsis, sepsis severa y shock séptico.
- Elección de DVA en shock séptico: Numerosos estudios han comparado vasopresores entre sí en shock séptico. La mayoría de las comparaciones no han encontrado diferencias en mortalidad, estadía en UCI, estadía en hospital o tasa de falla renal. Generalmente se compara NE con otro agente. En contraste, un metanálisis de seis ensayos randomizados encontraron mayor mortalidad en pacientes que recibieron dopamina en vez de NE en pacientes con shock séptico, además de presentar dos veces más frecuencia de arritmias en quienes usaron dopamina en vez de NE.
Basado en la información disponible, parece razonable elegir un vasopresor de acuerdo a las características del shock:
Shock séptico hiperdinámico: Se caracteriza por RVS baja y un alto GC, llevando a hipotensión y extremidades cálidas (sepsis caliente). DVA con acción α1 predominante, como NE y fenilefrina, son probablemente los más efectivos dado que la anormalidad más importante es la baja RVS. La Fenilefrina puede ser útil cuando la taquicardia u otras arritmias imposibiliten el uso de DVA con actividad β-adrenérgica.
Shock séptico hipodinámico: Se caracteriza por una leve a moderada baja en la RVS y bajo GC que lleva a hipotensión e hipoperfusión de la piel (sepsis fría). La NE como primera opción es razonable tanto por sus efectos α1 y β1 adrenérgicos. Para pacientes con hipotensión persistente y GC disminuido, un agente inotrópico es añadido frecuentemente. Se recomienda sumar Ep en esta situación, aunque la dobutamina también es una alternativa.
La vasopresina o terlipresina pueden ser beneficiosas cuando son administradas junto a otro vasopresor como la NE. Para pacientes que persisten hipotensos a pesar de dos DVA, no existe evidencia de que añadir una tercera droga sea mejor que combinar otras dos DVA diferentes. - “Dosis renal” de dopamina: La dopamina incrementa selectivamente el flujo plasmático renal cuando es administrada en voluntarios sanos a 1 – 3 mg/kg/min. Los pacientes críticos que no tienen evidencia de insuficiencia renal o menor débito urinario, tendrán mayor diuresis a una dosis de dopamina a 2 – 3 mg/kg/min, con efectos variables en el clearance de creatinina, pero el beneficio de esta diuresis provocada es cuestionable. La intervención no es del todo benigna por la hipotensión y taquicardia que puede causar. Actualmente no existe información que acredite que usando bajas dosis de dopamina de forma rutinaria prevenga o trate una falla renal aguda o isquemia mesentérica. En general, el hecho más efectivo en proteger los riñones en pacientes con shock séptico parece ser la mantención de una PAM > 60 mmHg evitando una vasoconstricción sistémica excesiva
- Dosis óptima: Muchos estudios sugieren que la perfusión tisular mejora con dosis más altas de NE (> 350 mcg/min). Sin embargo, no se ha demostrado un beneficio en la sobrevida cuando se ocupan dosis más altas de NE.
- Gasto cardiaco supranormal: La elevación del GC con inotrópicos a valores supranormales ( > 4.5 L/min por m2 ,por ejemplo) potencialmente incrementa la entrega periférica de oxigeno. En teoría, la mayor entrega de oxigeno previene la hipoxia tisular y mejoraría el pronóstico. Sin embargo, estudios mostraron que una terapia hemodinámica orientada por meta, como incrementar el GC >4.5 L/min por m2 o una entrega de oxigeno > 600 – 650 mL/min por m2 con expansores de volumen o dobutamina, no mostraron mejorar e incluso empeorar la morbilidad y mortalidad de los pacientes. Por lo tanto, actualmente, alcanzar estos valores no está recomendado.
Conclusión
En el manejo de patologías de urgencia muchas veces se requiere una buena destreza para realizar procedimientos e indicar oportunamente un tratamiento guiándose por algoritmos estandarizados. En el contexto del manejo de DVA, en el cual no existen recomendaciones estándares, no está demás conocer la fisiología que existe detrás de cada fármaco y sus efectos en los distintos escenarios fisiopatológicos que ofrecen los diferentes tipos de shock. El conocimiento de los receptores adrenérgicos y las consecuencias de su activación, es la piedra angular del manejo hemodinámico en pacientes con el diagnóstico de shock.
Clásicamente se asegura una buena volemia para que las DVA tengan una eficacia máxima, pero esto actualmente no es así en todos los escenarios ya que mediante la identificación de nuevos parámetros durante la monitorización invasiva de pacientes críticos, se han diferenciado perfiles de pacientes que no siempre responden a volumen, como cuando existe un shock cardiogénico de instalación aguda por un infarto al miocardio, en donde el aporte de DVA sería más apropiado que sobrecargar al paciente con fluidos y las complicaciones que esto trae.
Dentro de las DVA, la norepinefrina sigue siendo el fármaco de primera línea en pacientes con shock hipovolémico, cardiogénico y séptico. A excepción del uso de epinefrina como primera línea en el shock anafiláctico, el resto de las otras DVA, incluyendo la epinefrina, se ocupan como fármacos de segunda línea, es decir, se añaden a la acción de una primera DVA o la reemplazan cuando esta esté contraindicada. Es prudente evitar la dobutamina y la dopamina en el manejo del shock séptico como drogas de segunda línea.
Tener presente que ante un paciente que se ha mantenido bajo el manejo de DVA, se deben ir a buscar dirigidamente las complicaciones y el efecto de taquifilaxis, por lo que requieren un ajuste constante de las dosis administradas.
Por último, aun quedan muchas áreas en las cuales poner a prueba las distintas DVA para el manejo de pacientes críticos, haciendo énfasis en una buena categorización del diagnóstico de los pacientes y las dosis a utilizar.
Bibliografia
- Timothy E. et al (2014) State-of-the-art fluid management in the operating room.
- Sistema Nervioso Autónomo Cap. 16. Fisiologia cardiaca Cap.20.
- Evaluation of and initial approach to the adult patient with undifferentiated hypotension and shock.
- Cannesson et al.Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness: a “gray zone” approach. Anesthesiology 2011.
- UpToDate (2016) Use of vasopressors and inotropes

