Anemia por enfermedad crónica
17/07/2016
Generalidades
Las anemias que se asocian con eritrocitos normocíticos y normocrómicos, junto a una respuesta de reticulocitos muy baja (índice reticulocitario <2,0 a 2,5) son las anemias hipoproliferativas. Esta categoría comprende la ferropenia temprana (antes de que se produzcan eritrocitos hipocrómicos y microcíticos), la inflamación aguda y crónica, la insuficiencia renal, los estados hipometabólicos (desnutrición proteica y deficiencias endocrinas) y las anemias por lesión medular (aplásica [puede ser macrocítica], mieloptísica).
Las anemias hipoproliferativas son las anemias más comunes en clínica, estando en primer lugar la ferropénica seguida de la anemia por inflamación o enfermedades crónicas. Esta anemia, como la ferropénica, guarda relación en parte con un metabolismo anómalo del hierro. Las anemias que acompañan la insuficiencia renal, la inflamación, el cáncer y los estados hipometabólicos se caracterizan por una respuesta subóptima de la eritropoyetina a la anemia.
ANEMIA POR ENFERMEDAD CRÓNICA
Definición y epidemiología
La anemia por enfermedad crónica corresponde a aquella anemia asociada a distintas enfermedades infecciosas, inflamatorias y/o neoplásicas. Representa la segunda causa en orden de frecuencia de anemia, tras la ferropénica y es la más frecuente en pacientes hospitalizados.
Generalmente se caracteriza por ser una anemia normocítica y normocrómica, pero en ocasiones puede ser microcítica e hipocroma, estableciéndose entonces la necesidad del diagnóstico diferencial con la anemia ferropénica.
Etiología
Las principales causas de anemia por enfermedad crónica se resumen en la Tabla 1.
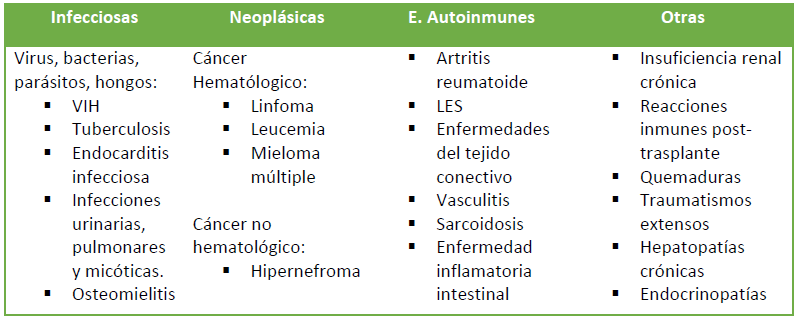
Tabla 1. Causas de anemia por enfermedad crónica.
Entre las principales causas de la anemia por enfermedad crónica se encuentran la tuberculosis, la endocarditis infecciosa, la osteomielitis; las infecciones urinarias, pulmonares, micóticas y por VIH. Destacan las enfermedades autoinmunes tales como la artritis reumatoide, el lupus eritematoso sistémico, la sarcoidosis, las vasculitis (p.ej. arteritis de la temporal) y las colagenopatías. Dentro de las neoplasias cabe destacar los carcinomas (p.ej. hipernefroma), la enfermedad de Hodgkin, el linfoma no Hodgkin, las leucemias crónicas y el mieloma múltiple. También las hepatopatías crónicas, la insuficiencia renal crónica, las endocrinopatías (hipo-hipertiroidismo, enfermedad de Addison, panhipopituitarismo) y las quemaduras o traumatismos extremos pueden ser la causa de la aparición de este tipo de anemia.
La prevalencia de anemia en pacientes con cáncer dependerá de los procedimientos terapéuticos y de su edad. Un estudio realizado el 2003 reportó que entre la población anciana un 77% de los hombres y un 68% de las mujeres con cáncer eran anémicos*. En otro estudio realizado el 2001, se evidenció anemia en el 41% de los pacientes con tumores sólidos previo al tratamiento con radioterapia y en el 54% de los pacientes posterior a éste**.
Fisiopatología
Se han propuesto diversos mecanismos para explicar la patogenia de la anemia por enfermedad crónica. Uno de ellos consiste en la disminución de la utilización del hierro de los macrófagos de depósito, que no pasa al plasma ni a los precursores de la serie roja, ocasionándose como consecuencia una disminución del hierro plasmático (hiposideremia) y una falta de utilización del hierro por los precursores eritroides. Este efecto parece mediado fundamentalmente por hepcidina, un reactante de fase aguda de síntesis hepática cuya concentración aumenta en la inflamación mediante una vía mediada por IL-6. Actúa suprimiendo la absorción y liberación de hierro de los sitios de almacenamiento. El detalle de este proceso se explica mediante la Figura 1.
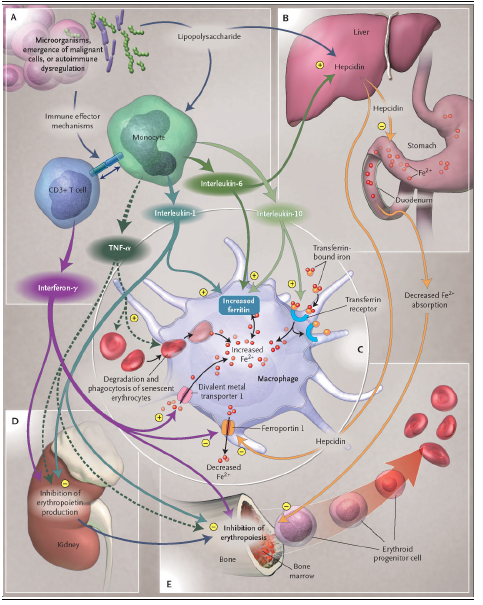
Figura 1. Mecanismos fisiopatológicos detrás de la anemia por enfermedad crónica.
Panel A: la invasión de microorganismos, la emergencia de células malignas o la desregulación autoinmune conlleva a la activación de céluas T (CD3+) y monocitos. Estas células inducen mecanismos efectores inmunes, por lo que producen citoquinas, tales como IF-γ (desde células T), TNF-α, IL-1, IL-6 e IL-10 (desde monocitos o macrófagos).
Panel B: IL-6 y lipopolisacáridos (LPS) estimulan la expresión hepática de la proteína de fase aguda hepcidina, la cual inhibe la absorción duodenal de hierro.
Panel C: IF-γ, LPS, o ambos aumentan la expresión de DMT1 (divalent metal transporter 1) en macrófagos y estimulan el consumo de hierro ferroso (Fe2+). La citoquina antiinflamatoria IL-10 regula positivamente la expresión del receptor de transferrina y aumenta la captación de hierro unido a transferrina por parte de los monocitos, mediante los receptores de transferrina. Además, los macrófagos activados fagocitan y degradan eritrocitos senescentes para el reciclaje del hierro, un proceso que es inducido por TNF-α mediante el daño a las membranas de los eritrocitos y la estimulación de la fagocitosis. IF-γ y LPS regulan negativamente la expresión del transportador de hierro de macrófagos llamado ferroportina 1, inhibiendo así la exportación de hierro desde los macrófagos, proceso que es también afectado por la hepcidina. Al mismo tiempo, TNF-α, IL-1, IL-6 e IL-10 inducen la expresión de ferritina y estimulan el depósito y retención de hierro dentro de los macrófagos. En resumen, estos mecanismos llevan a una concentración disminuida de hierro en la circulación, limitando la disponibilidad de hierro para las células eritroides.
Panel D: TNF-α e IF-γ inhiben la producción de eritropoyetina en el riñón.
Panel E: TNF-α, IF-γ e IL-1 inhiben directamente la diferenciación y proliferación de células progenitoras eritroides. Además, la disponibilidad limitada de hierro y la actividad biológica disminuida de la eritropoyetina lleva a la inhibición de la eritropoyesis y el desarrollo de anemia.
Adicionalmente, IL-1, provoca la liberación de gránulos leucocitarios por exocitosis que contienen lactoferrina, proteína más afín por el hierro que la transferrina. La lactoferrina no transfiere el hierro a los precursores eritroides. Remueve el hierro desde la transferrina, o compite con ella, para luego reincorporarlo a los macrófagos desde donde es desviado hacia los depósitos, impidiendo su uso en la producción de glóbulos rojos.
Otros mecanismos complementarios a la anemia en dichas enfermedades son el acortamiento de la vida de los glóbulos rojos, debido al aumento de la capacidad fagocítica del sistema monocito-macrofágico por macrófagos activados que actúan sobre los hematíes, así como una inadecuada respuesta de la médula ósea. Esta última, como consecuencia de una disminución de la eritropoyesis por la acción de citoquinas en un contexto de enfermedades crónicas, tal como se detalla en los párrafos anteriores.
Diagnóstico
La clínica de la anemia por enfermedad crónica está dada por el cuadro de base.
La anemia es leve a moderada, normocítica, normocrómica y arregenerativa. Sin embargo, en un 20 a 30% de los casos es microcítica e hipocrómica, por lo que constituye un diagnóstico diferencial de las anemias ferropénicas. El diagnóstico se basa en las alteraciones de metabolismo del hierro: disminución de la ferremia, disminución de la transferrina con saturación normal o levemente disminuida y depósitos de hierro aumentados (determinados por la ferritina sérica y hierro en macrófagos medulares). Una tabla comparativa de las dos principales causas de anemia normo(micro)cítica – normocrómica se presenta en la Tabla 2.
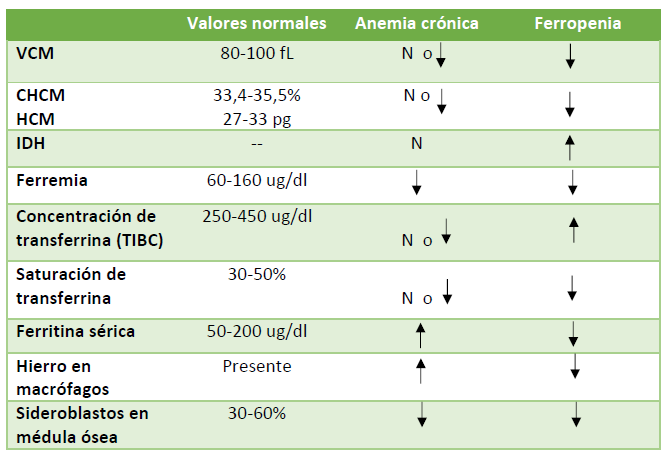
Tabla 2. Comparación del metabolismo del hierro de anemias por enfermedad crónica y por déficit de hierro. VCM: Volumen corpuscular medio. CHCM: Concentración de hemoglobina corpuscular media. HCM: Hemoglobina corpuscular media. IDH: índice de dispersión de hematíes. TIBC: capacidad total de fijación de hierro. N: normal.
La anemia por enfermedad crónica puede coexistir con otro tipo de anemia, destacando la anemia ferropénica como uno de los principales diagnósticos diferenciales. Ambas anemias presentan ferremia disminuida. Sin embargo, en la anemia ferropénica la capacidad total de fijación de hierro (TIBC) está aumentada con disminución de la saturación de la transferrina y de los depósitos de hierro, mientras que en la anemia por enfermedad crónica la TIBC se encuentra algo disminuida, con saturación normal o disminuida de la transferrina, además de depósitos de hierro elevados. Es este último parámetro bioquímico, la ferritina sérica, el que más ayuda a diferenciar ambos tipos de anemia.
Entre los parámetros del propio hemograma, una elevación del IDH es sugestiva de ferropenia.
El estudio de médula ósea mediante microscopía óptica y tinción de Perls es más exacto que la ferritina para evaluar los depósitos de hierro, sin embargo, se trata de una prueba diagnóstica cruenta por lo que su uso se restringe a casos de difícil diagnóstico.
Entre otros diagnósticos diferenciales cabe mencionar la anemia por insuficiencia renal, situación en la cual la eritropoyetina se encuentra disminuida en proporción al grado de anemia. Así también es relevante descartar la anemia por endocrinopatías y por enfermedad hepática alcohólica.
Tratamiento
No existe tratamiento específico, sino que debe ser el de la enfermedad asociada (procesos inflamatorios, infecciones crónicas, procesos tumorales).
A pesar de la hiposideremia, en esta enfermedad no debe administrarse hierro, ya que el problema no reside en la ausencia de hierro, sino en una mala utilización del mismo. Es por esto que el aporte de hierro solo está indicado en pacientes que presenten de manera concomitante un déficit de hierro absoluto demostrado, y en pacientes que reciben derivados eritropoyéticos, como aquellos con insuficiencia renal crónica en diálisis.
Las transfusiones están indicadas en pacientes sintomáticos, en casos de cirugía mayor, complicaciones hemorrágicas, entre otras.
Los agentes eritropoyéticos son ampliamente usados en la insuficiencia renal crónica y se recomienda realizar una prueba terapéutica en pacientes con cáncer que presenten una concentración de hemoglobina inferior a 10 g/dL.
Pronóstico y seguimiento
Antes de iniciar la terapia con agentes eritropoyéticos se debe descartar una deficiencia de hierro concomitante.
Para monitorear la respuesta a los agentes eritropoyéticos es necesaria la medición de los niveles de hemoglobina luego de 4 semanas de iniciada la terapia y en intervalos de 2 a 4 semanas posterior a ésta. Si los niveles de hemoglobina aumentan menos de 1 g/dL, debe reevaluarse el estado de hierro del paciente y considerar suplementos de hierro. Si no presenta una eritropoyesis con déficit de hierro, se debe indicar un aumento en un 50% de la dosis de los agentes eritropoyéticos. Una vez que la hemoglobina alcance concentraciones de 12 g/dL la dosis de estos agentes debe ser ajustada.
Si no se logra respuesta después de 8 semanas de tratamiento con dosis óptima, en ausencia de déficit de hierro, se considera que la anemia es refractaria a los agentes eritropoyéticos.
Resumen: Aspectos claves
- La anemia por enfermedades crónicas es la segunda causa en orden de frecuencia de anemia, tras la ferropenia. Es una anemia normocítica, normocrómica y arregenerativa, aunque puede ser microcítica e hipocrómica en el 20 a 30% de los casos.
- Hiposideremia no es sinónimo de ferropenia. La primera también aparece en la anemia de trastornos crónicos.
- El parámetro bioquímico de más ayuda para distinguir anemia de enfermedad crónica de anemia ferropénica es la ferritina sérica. Estará baja en la ferropénica y elevada en la de trastorno crónico.
- El tratamiento de la anemia por enfermedad crónica debe ser el de la enfermedad de base. Solo administrar hierro cuando existe déficit de éste concomitantemente. Uso de agentes eritropoyéticos y transfusiones, éstas últimas solo en pacientes sintomáticos.
Caso clínico
Paciente de sexo femenino de 57 años, con antecedente de artritis reumatoide, se presenta a la emergencia con quejas de fatiga que ha empeorado en los últimos meses. Su conjuntiva está pálida. Tiene signos de artritis reactiva en varias articulaciones metacarpianas y presenta una desviación ulnar prominente en ambas muñecas. Los exámenes de laboratorio son los siguientes:
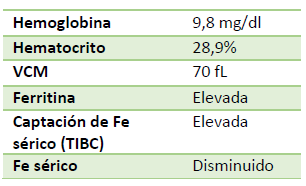
Se confirma la sospecha de anemia debido a los valores disminuidos de la hemoglobina y el hematocrito. La anemia es microcítica.
En la cinética del hierro destaca una hiposideremia acompañada de un aumento de los depósitos de hierro (ferritina elevada), situación que nos confirma la sospecha de anemia por enfermedad crónica. La captación de hierro sérico (TIBC), al contrario de lo esperado, se encuentra elevada, lo que nos demanda indagar la presencia de una anemia ferropénica concomitante.
Diagnóstico: – Anemia por enfermedad crónica (artritis reumatoide)
– Anemia ferropénica.
Tratamiento: Manejo de la enfermedad de base (AR) y administración de hierro de ser demostrado su déficit.
Bibliografía
1. Bases de la Medicina Clínica. Unidad 15: Hematología. Tema 15.2: Anemia por enfermedad crónica.
2. Hematología. Manual CTO de Medicina y Cirugía. 1era edición. Chile.
3. Principios de Medicina Interna. Harrison. McGraw Hill. 19a edición. 2015.
4. Anemia of chronic disease. Guenter Weiss, M.D. and Lawrence T. Goodnough, M.D. The New England Journal of Medicine. 2005.
*Dunn A, Carter J, Carter H. Anemia at the end of life: prevalence, significance and causes in patients receiving palliative care. J Pain Symptom Manage 2003; 26:1132-9.
**Harrison L, Shasha D, Shiaova L, White C, Ramdeen B, Portenoy R. Prevalence of anemia in cancer patients undergoing radiation therapy. Semion Oncol 2001; 28:54-9.
