Introducción
El trauma es una de las principales causas de morbimortalidad a nivel mundial, representando más del 10% de las muertes por esta causa (5.8 millones de personas)1, 2, número que se predice aumentará a más de 8 millones para el año 20203. Las lesiones ocurren de manera inesperada y con frecuencia afectan al segmento etario más productivo de la sociedad, entre los 15 y 44 años. La hemorragia post-traumática no controlada es la principal causa de muerte potencialmente prevenible entre los pacientes lesionados, siendo responsable hasta de un 40% de las mismas4, 5. Además, se ha establecido que entre un 25 y un 35% de los pacientes víctima de trauma se presentan con coagulopatía establecida a su llegada al servicio de urgencia, sin haber recibido aún una terapia de reposición hídrica, negando la antigua creencia que la hemodilución iatrogénica es el principal desencadenante de dicha coagulopatía6-9. La coagulopatía puede ser el resultado de trastornos fisiológicos como acidosis, hipotermia o hemodilución relacionada con la administración de líquidos o hemoderivados; sin embargo, también puede ocurrir una coagulopatía aguda en pacientes gravemente lesionados, independiente o sumado a estos factores10, 11. En la literatura se utilizan varios términos para referirse a esta afección, como coagulopatía traumática aguda (ATC), coagulopatía temprana del trauma (ECT), coagulopatía inducida por traumatismo (TIC) y coagulopatía aguda del shock traumático (ACOTS)12,13.
La coagulopatía en pacientes traumatizados, y específicamente la ATC, representa una carga económica significativa para las sociedades7. Este grupo de pacientes tiene un aumento significativo en los requerimientos de transfusiones, un aumento en la incidencia de síndrome de falla orgánica múltiple (FOM), mayor número de días de hospitalización, estancias más prolongadas en la unidad de cuidados intensivos y mayor riesgo de mortalidad en comparación con pacientes con lesiones similares en ausencia de coagulopatía6,15,16. A pesar de su importancia e impacto, el conocimiento de la coagulopatía inducida por trauma es poco, lo que conduce a un reconocimiento tardío y demora en la implementación del tratamiento adecuado lo que incrementa la morbilidad y mortalidad del paciente. Evidencia reciente sugiere que el tratamiento dirigido hacia una resucitación hemostática adecuada, agresiva y dirigida según las necesidades del paciente, puede conducir a una dramática mejoría en los resultados.
Fisiopatología
La coagulación normal es un equilibrio entre los procesos hemostáticos y fibrinolíticos que permiten el control de la hemorragia después de una lesión leve mientras se previene la trombosis intravascular inapropiada.
La coagulopatía asociada al trauma consiste en una falla global y multifactorial del sistema de coagulación que impide una adecuada hemostasia luego de un trauma mayor. Es de causa multifactorial, y dentro de las etiologías clásicas de la “triada viciosa”, están: la acidosis, relacionada con el daño tisular y el estado de shock; la hipotermia derivada de la exposición al frío y la administración de fluidos fríos; y la hemodilución debido a la administración de fluidos y/o hemoderivados. El consumo sistémico de factores de coagulación manifestado como coagulación intravascular diseminada (CID), puede ocurrir poco después de la lesión debido a una insuficiente repleción de factores de coagulación de cara a un consumo en curso, o más tarde en el hospital frente al desarrollo de una sepsis, por ejemplo. A diferencia de lo anterior, la coagulopatía traumática aguda (ATC) es una respuesta bioquímica al shock y daño tisular que lleva a un estado de hiperfibrinolisis e hipocoagulabilidad que está mediado por la desregulación del sistema de la proteína C.
Acidosis
La acidosis causa disfunción de la coagulación, demostrable en modelos experimentales a pH <7,2 al interferir con el ensamblaje de complejos de factores de coagulación que implican calcio y fosfolípidos cargados negativamente17, 18. Por ejemplo, la actividad del complejo Xa/Va/fosfolípido/protrombina, se reduce en un 50, 70, y 90% a un pH de 7,2, 7,0, y 6,8, respectivamente; incrementando a su vez la degradación del fibrinógeno19. Además un pH por debajo de 7.2 tiene efectos deletéreos, sobre las proteasas de la coagulación10, 20. Sin embargo, la corrección de la acidosis por sí sola no siempre corrige la coagulopatía asociada, lo que indica que la lesión del tejido causa coagulopatía a través de mecanismos adicionales21, 22.
Hipotermia
La hipotermia en los pacientes lesionados se clasifica en leve (36 a 34 ° C), moderada (34 a 32 ° C) o grave (<32 ° C)23. Se estima que aproximadamente dos tercios de los pacientes de trauma llegan al servicio de urgencia con una temperatura inferior a 36 °C; y de estos, 9% tienen una temperatura menor o igual a 33 °C24, 25, 26.
El efecto de la hipotermia sobre la coagulación incluye la inhibición de la actividad enzimática, así como la inhibición de la función plaquetaria24, 26. Es importante destacar que la coagulopatía por hipotermia no se ve reflejada en las pruebas de coagulación (estándar o viscoelásticas), debido a que las muestras de sangre por procesamiento estándar son precalentadas a 37°C.
La hipotermia por sí sola es un predictor independiente débil de mortalidad27. Sin embargo en conjunto a acidosis son sinérgicos con aumento de la mortalidad cuando ambos están presentes, en comparación a cada uno por separado28.
Coagulopatía asociada a la reanimación (dilucional)
La coagulopatía asociada a la reanimación (RAC), también denominada coagulopatía iatrogénica, se refiere a alteraciones del sistema de coagulación inducidas por grandes volúmenes de líquidos intravenosos o administración de componentes sanguíneos desequilibrados durante el manejo del shock29. La reanimación en trauma se ha centrado históricamente en el tratamiento de la hipotensión y acidosis con la administración agresiva de cristaloides, seguida de unidades de glóbulos rojos (PRBC). En ese momento, el tratamiento de la coagulopatía sólo se iniciaba en respuesta al resultado de pruebas de coagulación alteradas. De forma similar ocurría con la administración de plaquetas, solo cuando existía evidencia de trombocitopenia.
Existen numerosos estudios, modelos computacionales30, experimentos in vitro31 y estudios clínicos en voluntarios sanos que han constatado que grandes volúmenes de reanimación (cristaloides, coloides y PRBC), conducen a la dilución de las proteínas de coagulación del plasma32.
Otro factor que contribuye a la coagulopatía dilucional es el efecto del tiempo de almacenamiento de los glóbulos rojos empaquetados que presentan cambios funcionales y estructurales de forma progresiva. Estos cambios incluyen la disminución del pH, la quelación del calcio, bajos niveles de 2,3 difosfoglicerato, y la disminución de la concentración de factor de coagulación. La transfusión de sangre más antigua puede deteriorar aún más la perfusión microvascular, y tiene efectos inflamatorios e inmunomodulatorios33, 34.
Coagulopatía traumática aguda (ATC)
La coagulopatía traumática aguda (ATC) corresponde a la dificultad para lograr la hemostasia debida a la activación de la fibrinólisis que ocurre tempranamente después de la lesión y es bioquímicamente evidente antes e independiente del desarrollo de una acidosis, hipotermia o hemodilución significativa. El riesgo de ATC aumenta con la hipotensión, mayor puntuación de gravedad de la lesión, el empeoramiento del déficit de base, y el traumatismo cerebral11, 35, 36. Una vez establecida, la ATC suele ir acompañada de otras etiologías (acidosis, hipotermia y hemodilución). Además, la coagulopatía es modificada por factores individuales relacionados con el paciente que incluyen edad, antecedentes genéticos, comorbilidades, inflamación y premedicación, especialmente anticoagulantes orales y administración de fluidos prehospitalarios37-39. Figura 1.

Figura 1. Esquema de los factores, tanto preexistentes como relacionados con el trauma, que contribuyen a la coagulopatía traumática. Adaptado de Rossaint et al.40
Mecanismo
Bajo circunstancias normales, la lesión del tejido conduce a la generación de trombina, depósito de fibrina y formación de coágulos a través de la vía extrínseca (Figura 2).
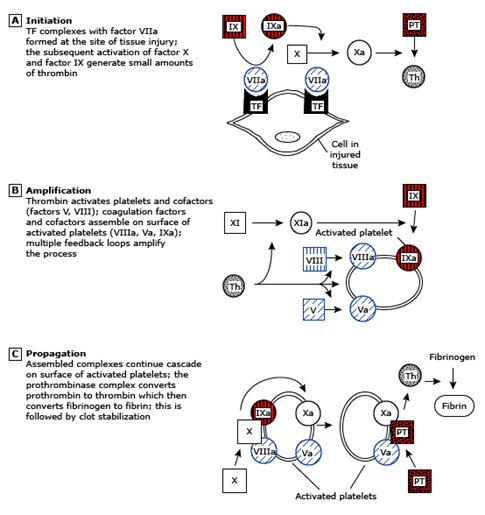
Figura 2. Cascada de la coagulación iniciada por la liberación de factor tisular en el sitio de la injuria. Los factores en cuadrados corresponden a las formas inactivas, mientras que en círculos, son las enzimas activas. PT: protrombina; Th: trombina. Fuente Uptodate 2016.
Al examinar la fisiopatología de la ATC es posible demostrar que son dos los principales factores responsables: el trauma tisular y la hipoperfusión sistémica. Estos dan como resultado una coagulopatía que se asocia con un aumento de los niveles plasmáticos de proteína C activada (aPC) y trombomodulina soluble elevada35. La activación del sistema trombomodulina-proteína C es la vía principal de la ATC, un mecanismo que es distinto del consumo o disfunción de los factores de la coagulación8, 10, 11, 41-44.
La aPC es una serina proteasa que forma parte de las vías naturales de anticoagulación. Esta vía de anticoagulación relacionada con la proteína C se inicia cuando la trombina se une a la trombomodulina en la superficie del endotelio en donde en asociación con un receptor de proteína C presente en las células endoteliales se promueve un aumento importante de la activación de dicha proteasa, la cual una vez activa ejerce sus efectos anticoagulantes a través de una inactivación irreversible de los factores Va y VIIIa45. Por lo tanto, la trombina en lugar de jugar un papel predominantemente procoagulante, desarrolla un rol patológico anticoagulante a través del exceso de activación de la proteína C35. Aunque los mecanismos bioquímicos precisos están todavía bajo materia de investigación, la importancia de la proteína C en este proceso ya ha sido confirmada. Se ha demostrado que la inhibición de la proteína C mediante un la utilización de anticuerpos en un modelo animal previene el desarrollo del ATC en respuesta al trauma y shock hemorrágico45.
Además, la proteína C activada posee una actividad anticoagulante mayor a través de la desactivación del inhibidor del plasminógeno activo-1 y de un aumento en la liberación del activador tisular del plasminógeno lo que resulta en un estado de hiperfibrinólisis35.
La aPC tiene también efectos antiinflamatorios y citoprotectores. La activación y consumo intensos de proteína C pueden agotar las reservas de proteína C, lo que puede dar lugar a secuelas infecciosas y trombóticas posteriores46, 47.
Evaluación y Diagnóstico.
Los pacientes traumatizados severamente lesionados son habitualmente evaluados con la realización de exámenes de laboratorio estándar, incluyendo hemograma, electrolitos plasmáticos, análisis de gases en sangre arterial y pruebas de coagulación estándar. Estos estudios de laboratorio proporcionan una estimación de la acidosis y la hemodilución, indican la gravedad del shock (medido por el déficit de base y/o el lactato), guían la administración de fluidos y hemoderivados, y sirven como base para la evaluación de la hemorragia en curso.
Las pruebas de coagulación: tiempo de protrombina (TP), índice normalizado internacional (INR) y tiempo de tromboplastina parcial activada (TTPa); son el estándar actual para establecer el diagnóstico definitivo de coagulopatía. Un TP > 18 segundos43, INR > 1,5 (81), TTPa > 60 segundos, o cualquiera de estos valores en un umbral de 1,5 veces el valor de referencia del laboratorio82, hace el diagnóstico. La prevalencia del TP prolongado es mayor, pero la prolongación del TTPa es más específico11.
Sin embargo, así como el recuento plaquetario y la medición de fibrinógeno son pruebas estáticas y solo capturan un pequeño instante de todo el proceso de coagulación, por lo que es posible que estas pruebas resulten normales mientras el estado general de la coagulación del paciente es normal41. Además, estas pruebas no pueden evaluar el efecto de la hipotermia, acidosis, hipocalcemia o anemia en la hemostasia y por ello no reflejan el estado de la coagulación in vivo del paciente. Otro inconveniente con la realización de estas pruebas durante la valoración de un paciente víctima de trauma consiste en que los resultados de las mismas toman demasiado tiempo, alrededor de 30 a 60 minutos. El retraso en la disponibilidad de los resultados puede hacerlos irrelevantes ante la hemorragia exangüinante. Debido a las limitaciones anteriores, han tomado importancia pruebas como la tromboelastografía y la tromboelastometría rotacional, exámenes que evalúan en tiempo real todo el proceso de la coagulación. A continuación se describe uno de ellos.
Tromboelastografía
La tromboelastografía es una prueba que evalúa las propiedades viscoelásticas de la formación del coágulo en sangre fresca o citratada, en tiempo real. La prueba sintetiza la información obtenida de múltiples pruebas de coagulación (TP, TTPa, tiempo de trombina, nivel de fibrinógeno y recuento de plaquetas) en una única lectura, proporcionando información sobre la formación de fibrina, la velocidad de formación del coagulo así como también la fuerza, la estabilidad y la lisis del mismo de manera simultánea. Hasta hace poco, la mayor parte de su uso clínico ha sido en la monitorización durante la realización de bypass cardiopulmonar49 y trasplante hepático50. Como una prueba funcional de la formación y lisis del coágulo, permite controlar el progreso o la resolución de la coagulopatía después de la lesión, dirigiendo al médico hacia el tipo de hemoderivados e intervenciones más efectivas en el manejo de la hemorragia en dicho paciente. Otra ventaja de estos estudios, es que los resultados se pueden obtener en un plazo de 10 minutos aproximadamente.
Conclusión. Conceptos fundamentales.
El trauma en la actualidad ha llegado a ocupar un lugar de gran importancia como causa de morbimortalidad dentro de la sociedad moderna alrededor del mundo, alcanzando más de 5 millones de muertes por esta causa. Es por este motivo que el conocimiento de los diferentes mecanismos involucrados en la patogénesis de la coagulopatía inducida por trauma es necesario, ya que su correcta comprensión permite sustentar las bases para un adecuado diagnóstico y tratamiento, con lo cual se mejoran los resultados de los pacientes victimas de trauma.
Actualmente se utilizan las pruebas de coagulación habituales para hacer el diagnóstico de coagulopatía, sin embargo, estas tienen algunas limitaciones, ya que al ser pruebas estáticas no reflejan el estado de la coagulación en todo momento. Debido a esto, han surgido nuevos test para evaluar el proceso de la coagulación en tiempo real, la tromboelastografía y la tromboelastometría rotacional.
Bibliografía.
1. World Health Organization. Injuries and violence: the facts; http://apps.who.int/iris/bitstream/10665/149798/1/9789241508018_eng.pdf; 2014. Accessed 2 Nov 2016.
2. GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age–sex specific all-cause and cause specific mortality for 240 Rossaint et al. Critical Care (2016) 20:100 Page 40 of 55 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;385(9963):117–71.
3. Murray CJ, Lopez AD. Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study. Lancet. 1997;349(9064):1498–504.
4. World Health Organization. Cause-specific mortality and morbidity. 2009. http://www.who.int/whosis/whostat/EN_WHS09_Table2.pdf. Accessed 2 Nov 2016.
5. Cothren CC, Moore EE, Hedegaard HB, Meng K. Epidemiology of urban trauma deaths: a comprehensive reassessment 10 years later. World J Surg. 2007;31(7):1507–11.
6. Cap A, Hunt BJ. The pathogenesis of traumatic coagulopathy. Anaesthesia. 2015;70:96-101.
7. Schöchl H, Nienaber U, Maegele M, Hochleitner G, Primavesi F, Steitz B, et al. Transfusion in trauma: thromboelastometry-guided coagulation factor concentrate-based therapy versus standard fresh frozen plasma-based therapy. Crit Care. 2011;15(2):R83.
8. Maegele M, Schochl H, Cohen MJ. An update on the coagulopathy of trauma. Shock. 2014;41 Suppl 1:21–5.
9. Khan S, Davenport R, Raza I, Glasgow S, De’Ath HD, Johansson PI, et al. Damage control resuscitation using blood component therapy in standard doses has a limited effect on coagulopathy during trauma hemorrhage. Intensive Care Med. 2015;41(2):239–47.
10. Brohi K, Cohen MJ, Davenport RA. Acute coagulopathy of trauma: mechanism, identification and effect. Curr Opin Crit Care. 2007;13:680-685.
11. MacLeod JB, Lynn M, McKenney MG, Cohn SM, Murtha M. Early coagulopathy predicts mortality in trauma. J Trauma. 2003;55(1):39–44.
12. Frith D, Davenport R, Brohi K. Acute traumatic coagulopathy. Curr Opin Anaesthesiol. 2012;25(2):229–34.
13. Engels PT, Rezende-Neto JB, Al Mahroos M, Scarpelini S, Rizoli SB, Tien HC. The natural history of trauma-related coagulopathy: implications for treatment. J Trauma. 2011;71(5 Suppl 1):S448–55.
14. Campbell HE, Stokes EA, Bargo DN, Curry N, Lecky FE, Edwards A, et al. Quantifying the healthcare costs of treating severely bleeding major trauma patients: a national study for England. Crit Care. 2015;19(1):276.
15. Maegele M, Lefering R, Yucel N, Tjardes T, Rixen D, Paffrath T, et al. Early coagulopathy in multiple injury: an analysis from the German Trauma Registry on 8724 patients. Injury. 2007;38(3):298–304.
16. Moore EE, Knudson MM, Jurkovich GJ, Fildes JJ, Meredith JW. Emergency traumatologist or trauma and acute care surgeon: decision time. J Am Coll Surg. 2009;209(3):394–5.
19. Levi M, van der Poll T, ten Cate H, van Deventer SJ. The cytokine mediated imbalance between coagulant and anticoagulant mechanisms in sepsis and endotoxaemia. Eur J Clin Invest. 1997;27:3 9.
20. Eastridge BJ, Mabry RL, Seguin P, et al. Death on the battlefi eld (2001-2011): Implications for the future of combat casualty care. J Trauma Acute Care Surg. 2012;73:s431-437.
23. Tsuei BJ, Kearney PA. Hypothermia in the trauma patient. Injury 2004; 35:7.
29. Schreiber MA. Coagulopathy in the trauma patient. Curr Opin Crit Care 2005; 11:590.
37. Hess JR, Lawson JH. The coagulopathy of trauma versus disseminated intravascular coagulation. J Trauma. 2006;60(6 Suppl):S12–9.
38. Spahn DR, Rossaint R. Coagulopathy and blood component transfusion in trauma. Br J Anaesth. 2005;95(2):130–9.
39. Hussmann B, Lefering R, Waydhas C, Touma A, Kauther MD, Ruchholtz S, et al. Does increased prehospital replacement volume lead to a poor clinical course and an increased mortality? A matched-pair analysis of 1896 patients of the Trauma Registry of the German Society for Trauma Surgery who were managed by an emergency doctor at the accident site. Injury. 2013;44(5):611–7.
40. Rossaint et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Critical Care 2016; 20:100
41. Johansson PI, Sorensen AM, Perner A, Welling KL, Wanscher M, Larsen CF, et al. Disseminated intravascular coagulation or acute coagulopathy of trauma shock early after trauma? An observational study. Crit Care. 2011;15(6):R272.
42. Frith D, Brohi K. The pathophysiology of trauma-induced coagulopathy. Curr Opin Crit Care. 2012;18(6):631–6.
43. Hagemo JS, Christiaans SC, Stanworth SJ, Brohi K, Johansson PI, Goslings JC, et al. Detection of acute traumatic coagulopathy and massive transfusión requirements by means of rotational thromboelastometry: an international prospective validation study. Crit Care. 2015;19:97.
44. Hagemo JS, Stanworth S, Juffermans NP, Brohi K, Cohen M, Johansson PI, et al. Prevalence, predictors and outcome of hypofibrinogenaemia in trauma: a multicentre observational study. Crit Care. 2014;18(2):R52.
46. Mosnier LO, Zlokovic BV, Griffin JH. The cytoprotective protein C pathway. Blood 2007; 109:3161.
50. Kang Y. Thromboelastography in liver transplantation. Semin Thromb Hemost 1995; 21 Suppl 4:34.

