Introducción
El esófago de Barret (EB) es una condición adquirida en la que el epitelio escamoso estratificado que recubre el esófago distal es reemplazado por epitelio intestinal, como consecuencia de la Enfermedad por Reflujo Gastroesofágico (ERGE). Se trata de una metaplasia con potencial oncogénico, ya que predispone a desarrollar adenocarcinoma de esófago (ADC), siendo 20 a 60 veces más frecuente el desarrollo de ADC en este grupo que en la población general.
Epidemiología
La edad promedio de diagnóstico del EB es de 50-60 años y se describe que es entre 2 a 3 veces más frecuente en hombres que en mujeres. En la población adulta occidental la prevalencia es entre el 1.6-6.8%. Puede presentarse en niños, pero es muy infrecuente, sobre todo en menores de 5 años. La prevalencia de EB en la población negra e hispánica parece ser menor que en la población blanca. Los estudios realizados en autopsias sugieren que la mayoría de los casos son asintomáticos y que no son diagnosticados durante la vida de los pacientes. La incidencia de ADC ha aumentado progresivamente en los últimos años, por lo que se han investigado nuevas herramientas para el diagnóstico precoz.
Factores de riesgo
Para el desarrollo de EB se requiere de predisposición genética asociado a exposición ambiental, al igual que otras condiciones premalignas. Dentro de los factores de riesgo y asociaciones al desarrollo de EB se encuentran:
- ERGE: Principal factor de riesgo. El 10 al 15% de todos los pacientes con ERGE presentarán Esófago de Barrett durante su evolución. Además, en relación a esta enfermedad, se ha asociado al desarrollo de EB una historia de síntomas de reflujo de inicio precoz, duración prolongada de síntomas, aumento de la intensidad de síntomas en supino, presencia de complicaciones del ERGE.
- Edad avanzada.
- Sexo masculino.
- Tabaquismo.
- Obesidad.
- Agregación familiar: no existe claridad de si se debe a predisposición genética o factores ambientales.
Patogénesis
El EB es el resultado de del daño provocado por el reflujo patológico sobre la mucosa esofágica, lo que estimularía la diferenciación de células madres hacia un fenotipo de tipo intestinal o bien induciría factores de transcripción que trasformarían células escamosas en columnares. Se han descrito como responsables alteraciones cromosómicas, mutaciones genéticas y metilación del DNA, las cuales silenciarían un gen supresor de tumores. Estudios in vitro sugieren que la exposición episódica de la mucosa esofágica al ácido puede producir daños al ADN, estimular la hiperproliferación y suprimir la apoptosis.
Cuadro Clínico
El EB no causa síntomas, por lo que el cuadro clínico de estos pacientes es similar a quienes padecen de ERGE sin EB. Por esta razón la Asociación Americana de Gastroenterología ha sugerido que todo paciente mayor de 50 años con ERGE debe ser evaluado por lo menos una vez con endoscopía.
Diagnóstico
El diagnóstico se realiza mediante endoscopía y morfológicamente se observa como una extensión del epitelio gástrico por sobre la línea Z (Unión de epitelio gástrico y esofágico). Su confirmación es a través de histología que evidencia metaplasia columnar con células caliciformes.
Se puede clasificar según su longitud en EB largo, con longitud de la metaplasia mayor o igual a 3 cm, o EB corto, con longitud menor a 3 cm.
La clasificación de Praga caracteriza la extensión de la metaplasia incluyendo longitud máxima de lengüeta (M) y la extensión circunferencial (C).
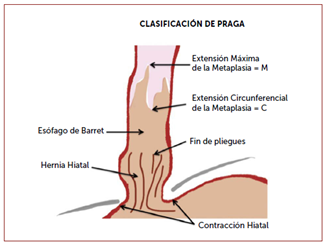
Figura 1. Clasificación de Praga (Ramírez, 2015)
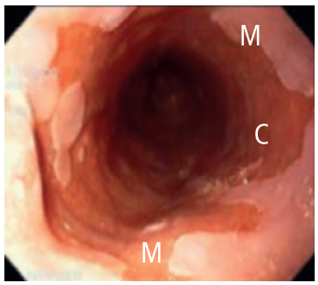
Figura 2. Esófago de Barrett mostrando el área de extensión circunferencial (C) y la extensión máxima (M). (Quera, 2008).
Todas las lesiones visibles deben describirse según la clasificación de París, que caracteriza las lesiones según su morfología en elevadas, planas o deprimidas.
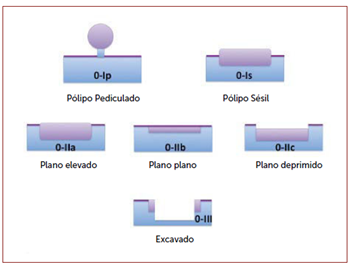
Figura 3. Clasificación de París. (Ramírez, 2015).
Riesgo de Malignización
La ERGE y el EB son los principales factores de riesgo de ADC. Factores que podrían contribuir al aumento de la incidencia de ADC en los últimos años son el aumento de la obesidad central, disminución de la infección por Helicobacter pilory y una dieta con mayor contenido de nitratos.
En estudios iniciales se correlacionaba EB largo a mayor riesgo de ADC en comparación con EB corto. Sin embargo estudios actuales no han podido confirmar que la diferenciación de longitud tenga importancia en el pronóstico o manejo.
En los pacientes que presentan displasia de alto grado (DAG) la tasa de desarrollo de cáncer es de 4 a 8% al año. Para pacientes con displasia de bajo grado (DBG) el riesgo de cáncer es tan mal definido que no es posible proporcionar una estimación precisa.
Manejo y vigilancia
El manejo involucra tres componentes: tratamiento de ERGE asociada, vigilancia endoscópica y tratamiento de la displasia.
A. Tratamiento de ERGE asociada: El paso inicial es la eliminación de los síntomas de reflujo y la mejoría de la esofagitis endoscópica. Consiste en modificaciones del estilo de vida (pérdida de peso, evitar posición supina 2-3 hrs después de comidas, eliminar alimentos que intensifiquen el reflujo) y en el uso de inhibidores de la bomba de protones.
B. Vigilancia endoscópica: Su recomendación se debe a que podría disminuir la mortalidad, aunque no se ha demostrado por ensayos prospectivos. Por otra parte, el cáncer de esófago es una causa poco frecuente de muerte en pacientes con EB, ya que estos pacientes fallecen por otras comorbilidades antes que ADC.
Actualmente la Asociación Americana de Gastroenterología indica que no existe evidencia de beneficio en realizar screening endoscopico en pacientes ERGE sin factores de riesgo. Sin embargo lo recomienda en caso de existir edad mayor a 50 años, sexo masculino, raza blanca, hernia hiatal, elevado índice de masa corporal, ERGE crónico u obesidad de predominio intraabdominal.
Si no existe displasia se recomienda realizar endoscopía cada 3-5 años, en DBG cada 6-12 meses y en DAG, en ausencia de erradicación, cada 3 meses.
Se han propuesto marcadores moleculares y múltiples técnicas endoscópicas (colorantes, endoscopía, etc.) como métodos de vigilancia, sin embargo no han sido probados para uso clínico de rutina o no han demostrado proporcionar información adicional.
C.Tratamiento de la displasia: Se recomienda que pacientes con DAG se realice terapia de erradicación endoscópica con ablación por radiofrecuencia, terapia fotodinámica y/o resección mucosa endoscópica. La esofagectomía y adenectomía se asocia a complicaciones graves en 30-50% de los casos y no garantiza la curación del tumor que ya ha hecho metástasis, por lo que su realización se restringe a casos muy particulares.
Bibliografía:
- American Gastroenterological Association Medical Position Statement on the Management of Barrett’s Esophagus. Gastroenterology 2011; 140: 1084-1091. Pagina Web: http://www.gastrojournal.org/article/S0016-5085(11)00084-9/pdf
- Quera R., Valenzuela J. Esofago de Barrett: La antesala del adenocarcinoma de esófago. REV. MED. CLIN. CONDES. 2008; 19(4) 316 – 321.
- Ramírez MA, Fluxá F. Esófago de Barrett: Revisión de la Literatura. REV. MED. CLIN. CONDES. 2015; 26(5) 557 – 564.
- Manual de Patología Quirúrgica, Fernardo Crovari. Editorial Ediciones UC, textos universitarios, PUC.

